Номер 12, страница 21 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 3. Хлор - номер 12, страница 21.
№12 (с. 21)
Условие. №12 (с. 21)
скриншот условия

12. Кремний реагирует с хлором с образованием высшего хлорида. Напишите уравнение реакции. Составьте электронный баланс, назовите окислитель и восстановитель.
Решение. №12 (с. 21)
Решение 2. №12 (с. 21)
Решение
1. Уравнение реакции
Кремний ($Si$) находится в 14-й группе (IVA) периодической таблицы, его высшая валентность равна IV, а высшая степень окисления +4. Хлор ($Cl$) как более электроотрицательный элемент будет иметь степень окисления -1. Следовательно, формула высшего хлорида кремния — $SiCl_4$ (тетрахлорид кремния).
Реакция взаимодействия простого вещества кремния с хлором (двухатомная молекула $Cl_2$) приводит к образованию тетрахлорида кремния. Уравнение реакции выглядит следующим образом:
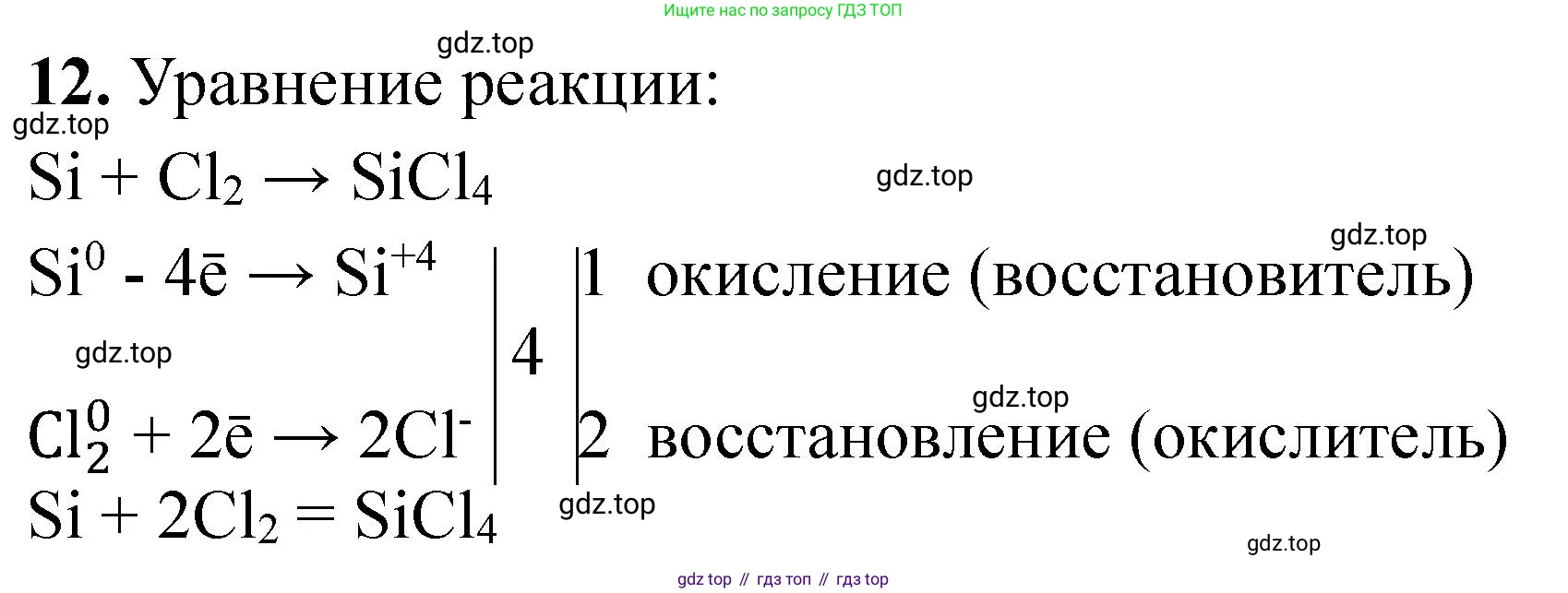
$$Si + 2Cl_2 \rightarrow SiCl_4$$
2. Электронный баланс
Для составления электронного баланса определим степени окисления элементов до и после реакции:
$$ \overset{0}{Si} + 2\overset{0}{Cl_2} \rightarrow \overset{+4}{Si}\overset{-1}{Cl_4} $$
Кремний изменяет степень окисления с 0 до +4, то есть отдает 4 электрона (окисляется). Хлор изменяет степень окисления с 0 до -1, то есть каждый атом хлора принимает 1 электрон (восстанавливается).
Запишем полуреакции:
$Si^0 - 4e^- \rightarrow Si^{+4}$ | 1 | процесс окисления
$Cl_2^0 + 2 \cdot 1e^- \rightarrow 2Cl^{-1}$ | 2 | процесс восстановления
Наименьшее общее кратное для отданных (4) и принятых (2) электронов равно 4. Расставляем коэффициенты: 1 перед кремнием и 2 перед молекулой хлора. Баланс сходится.
3. Окислитель и восстановитель
Восстановитель — это атом, молекула или ион, который отдает электроны в ходе окислительно-восстановительной реакции. В данном случае кремний ($Si^0$) отдает электроны, поэтому он является восстановителем.
Окислитель — это атом, молекула или ион, который принимает электроны. В данной реакции хлор ($Cl_2^0$) принимает электроны, поэтому он является окислителем.
Ответ:
Уравнение реакции: $Si + 2Cl_2 \rightarrow SiCl_4$.
Электронный баланс:
$Si^0 - 4e^- \rightarrow Si^{+4}$ | 1 | восстановитель (процесс окисления)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 2 | окислитель (процесс восстановления)
Окислитель: хлор, $Cl_2$.
Восстановитель: кремний, $Si$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 12 расположенного на странице 21 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №12 (с. 21), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















