Номер 11, страница 195 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 40. Соединения хрома. Зависимость кислотно-основных и окислительно-восстановительных свойств от степени окисления металла - номер 11, страница 195.
№11 (с. 195)
Условие. №11 (с. 195)
скриншот условия

11. Определите массу оксида хрома(III), который может быть получен из 16,2 г хромата натрия.
Решение. №11 (с. 195)

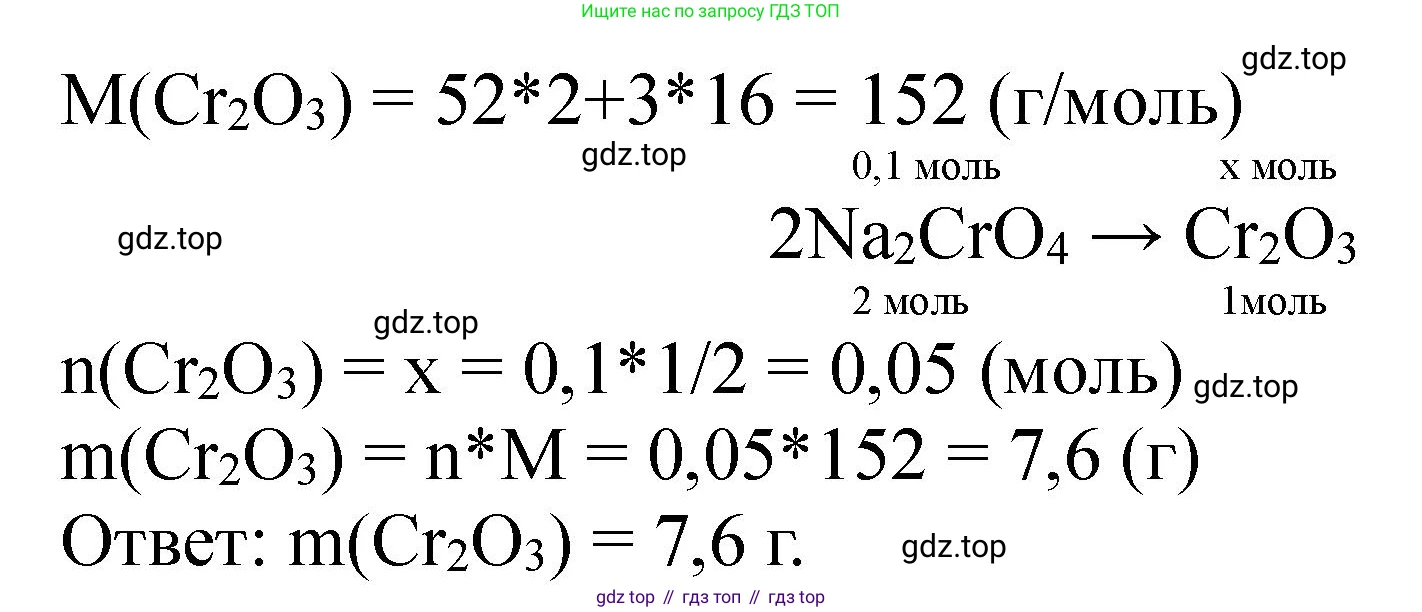
Решение 2. №11 (с. 195)
Дано:
$m(Na_2CrO_4) = 16,2$ г
Найти:
$m(Cr_2O_3) - ?$
Решение:
Для решения задачи необходимо определить стехиометрическое соотношение между исходным веществом, хроматом натрия ($Na_2CrO_4$), и конечным продуктом, оксидом хрома(III) ($Cr_2O_3$). Независимо от конкретного пути реакции, количество атомов хрома должно сохраняться.
В одной формульной единице хромата натрия ($Na_2CrO_4$) содержится один атом хрома ($Cr$).
В одной формульной единице оксида хрома(III) ($Cr_2O_3$) содержится два атома хрома ($Cr$).
Это означает, что для образования одной молекулы $Cr_2O_3$ требуется два атома хрома, которые должны поступить из двух молекул $Na_2CrO_4$. Таким образом, мольное соотношение между хроматом натрия и оксидом хрома(III) составляет 2:1.
$2Na_2CrO_4 \rightarrow Cr_2O_3$ (схема превращения по атому хрома)
Из этого следует, что количество вещества оксида хрома(III) будет в два раза меньше, чем количество вещества хромата натрия:
$n(Cr_2O_3) = \frac{1}{2} n(Na_2CrO_4)$
1. Рассчитаем молярную массу хромата натрия ($Na_2CrO_4$), используя периодическую таблицу химических элементов (атомные массы округлим до целых: Na - 23, Cr - 52, O - 16):
$M(Na_2CrO_4) = 2 \times Ar(Na) + Ar(Cr) + 4 \times Ar(O) = 2 \times 23 + 52 + 4 \times 16 = 46 + 52 + 64 = 162$ г/моль.
2. Найдем количество вещества ($n$) хромата натрия массой 16,2 г:
$n(Na_2CrO_4) = \frac{m(Na_2CrO_4)}{M(Na_2CrO_4)} = \frac{16,2 \text{ г}}{162 \text{ г/моль}} = 0,1$ моль.
3. Рассчитаем количество вещества оксида хрома(III), которое может быть получено:
$n(Cr_2O_3) = \frac{1}{2} \times n(Na_2CrO_4) = \frac{1}{2} \times 0,1 \text{ моль} = 0,05$ моль.
4. Рассчитаем молярную массу оксида хрома(III) ($Cr_2O_3$):
$M(Cr_2O_3) = 2 \times Ar(Cr) + 3 \times Ar(O) = 2 \times 52 + 3 \times 16 = 104 + 48 = 152$ г/моль.
5. Найдем массу оксида хрома(III), зная его количество вещества и молярную массу:
$m(Cr_2O_3) = n(Cr_2O_3) \times M(Cr_2O_3) = 0,05 \text{ моль} \times 152 \text{ г/моль} = 7,6$ г.
Ответ: масса оксида хрома(III), который может быть получен, составляет 7,6 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 11 расположенного на странице 195 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №11 (с. 195), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















