Номер 2, страница 210 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 44. Соединения железа - номер 2, страница 210.
№2 (с. 210)
Условие. №2 (с. 210)
скриншот условия

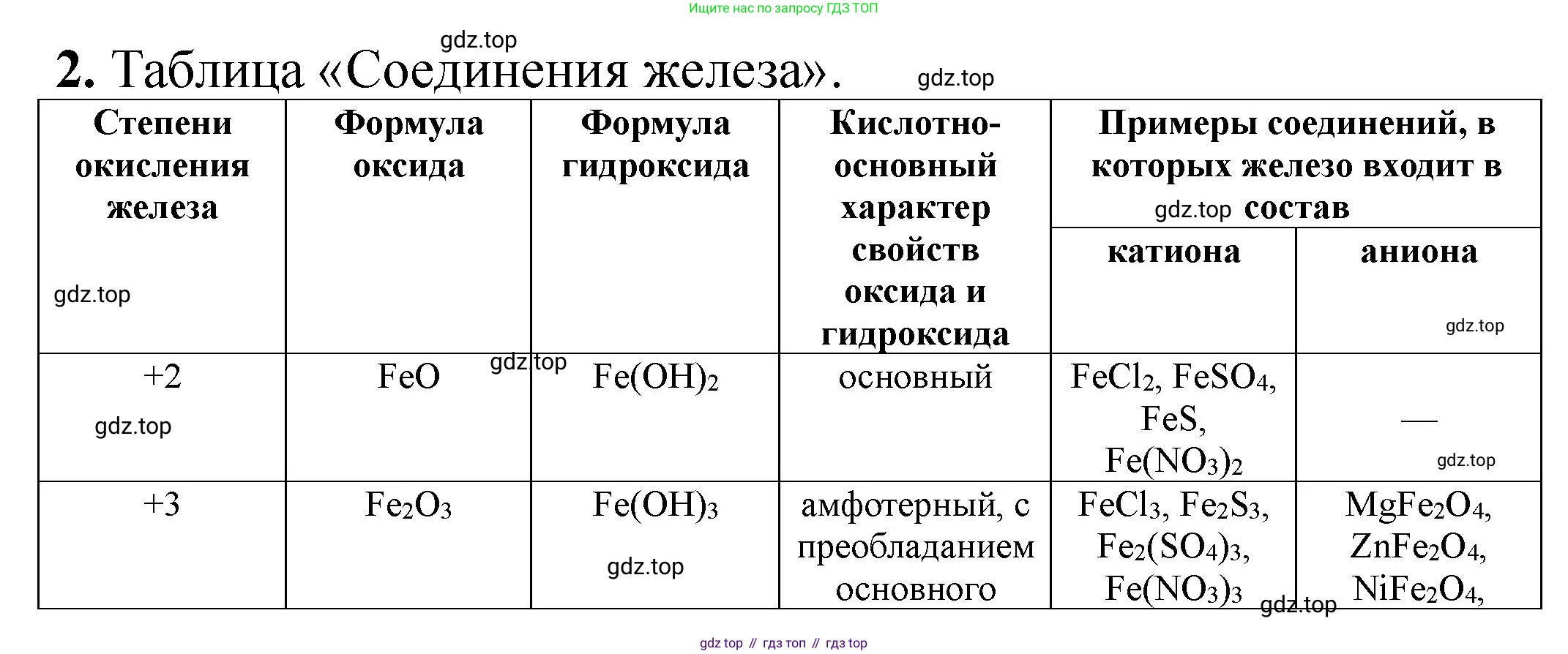
2. Заполните таблицу 11.
Таблица 11
Соединения железа
Степень окисления железа
Формула оксида
Формула гидроксида
Кислотно-основный характер свойств оксида и гидроксида
Примеры соединений, в которых железо входит в состав
катиона
аниона
+2
+3
Решение. №2 (с. 210)
Решение 2. №2 (с. 210)
Степень окисления железа +2
Формула оксида: $FeO$. Это оксид железа(II).
Формула гидроксида: $Fe(OH)_2$. Это гидроксид железа(II), нерастворимое в воде вещество белого цвета, которое быстро зеленеет, а затем буреет на воздухе из-за окисления.
Кислотно-основный характер оксида и гидроксида: Основный. Оксид и гидроксид железа(II) реагируют с кислотами, образуя соли железа(II) и воду. Например: $FeO + 2HCl \rightarrow FeCl_2 + H_2O$.
Примеры соединений, в которых железо входит в состав катиона: Соли железа(II), такие как хлорид железа(II) $FeCl_2$ или сульфат железа(II) $FeSO_4$. В этих соединениях железо существует в виде катиона $Fe^{2+}$.
Примеры соединений, в которых железо входит в состав аниона: Комплексные соли, например, гексацианоферрат(II) калия (жёлтая кровяная соль) $K_4[Fe(CN)_6]$. В этом соединении железо является центральным атомом в комплексном анионе $[Fe(CN)_6]^{4-}$.
Ответ: Формула оксида - $FeO$; формула гидроксида - $Fe(OH)_2$; кислотно-основный характер - основный; пример соединения с железом в составе катиона - $FeCl_2$; пример соединения с железом в составе аниона - $K_4[Fe(CN)_6]$.
Степень окисления железа +3
Формула оксида: $Fe_2O_3$. Это оксид железа(III), основный компонент ржавчины.
Формула гидроксида: $Fe(OH)_3$. Это гидроксид железа(III), нерастворимое в воде вещество бурого цвета.
Кислотно-основный характер оксида и гидроксида: Амфотерный. Оксид и гидроксид железа(III) реагируют как с кислотами, так и с концентрированными растворами щелочей или при сплавлении с ними. Реакция с кислотой: $Fe(OH)_3 + 3HCl \rightarrow FeCl_3 + 3H_2O$. Реакция со щелочью при сплавлении: $Fe_2O_3 + 2NaOH \rightarrow 2NaFeO_2 + H_2O$.
Примеры соединений, в которых железо входит в состав катиона: Соли железа(III), такие как хлорид железа(III) $FeCl_3$ или нитрат железа(III) $Fe(NO_3)_3$. В этих соединениях железо существует в виде катиона $Fe^{3+}$.
Примеры соединений, в которых железо входит в состав аниона: Ферриты (например, феррит натрия $NaFeO_2$) или комплексные соли (например, гексацианоферрат(III) калия (красная кровяная соль) $K_3[Fe(CN)_6]$). В первом случае железо входит в состав аниона $FeO_2^{-}$, во втором - в состав комплексного аниона $[Fe(CN)_6]^{3-}$.
Ответ: Формула оксида - $Fe_2O_3$; формула гидроксида - $Fe(OH)_3$; кислотно-основный характер - амфотерный; пример соединения с железом в составе катиона - $FeCl_3$; пример соединения с железом в составе аниона - $K_3[Fe(CN)_6]$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 210 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 210), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















