Номер 9, страница 444 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Практикум. Практическая работа - номер 9, страница 444.
№9 (с. 444)
Условие. №9 (с. 444)
скриншот условия



Практическая работа 9. Скорость химических реакций. Химическое равновесие
Реактивы: растворы иодида калия (1%-й и 0,5%-й), пероксида водорода (3%-й), оксида кремния, марганца(IV), железа(III); крахмальный клейстер; мел; мрамор; растворы хлорида железа(III) и роданида аммония.
Оборудование и материалы: штатив с пробирками, спиртовка, держатель для пробирок, секундомер.
1. Пронумеруйте четыре пробирки, закрепив на них бумажки с номерами или сделав на них надписи маркером. В две первые пробирки прилейте по 2 мл 0,5%-го раствора иодида калия (или иодида натрия), а в третью и четвёртую — по 2 мл 1%-й раствор этой соли. Во все пробирки внесите по несколько капель крахмального клейстера. Растворы в пробирках 2 и 4 нагрейте до кипения. Затем ко всем четырём пробиркам прилейте равные объёмы 3%-го раствора пероксида водорода, выполнив это по возможности одновременно. Отметьте последовательность появления синей окраски. Опыт можно поставить более строго при наличии секундомера. В этом случае его надо проводить последовательно с каждым раствором, включая секундомер во время приливания пероксида водорода и останавливая его при появлении синей окраски. Результаты наблюдений перенесите в таблицу.
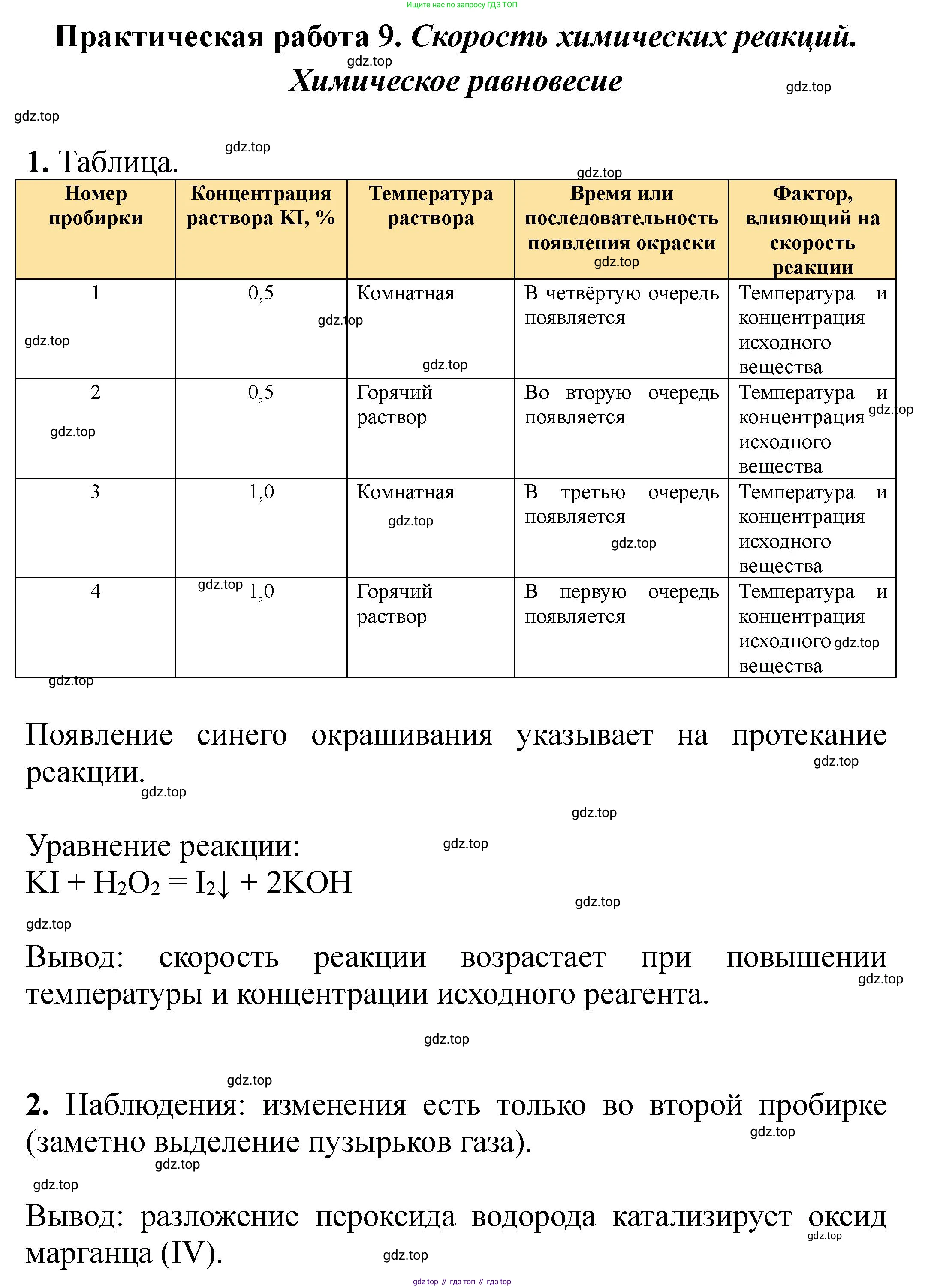
| Номер пробирки | Концентрация раствора KI, % | Температура раствора | Время или последовательность появления окраски | Фактор, влияющий на скорость реакции |
| 1 | 0,5 | Комнатная | ||
| 2 | 0,5 | Горячий раствор | ||
| 3 | 1,0 | Комнатная | ||
| 4 | 1,0 | Горячий раствор |
О чём свидетельствует появление синего окрашивания? Напишите уравнение реакции, зная, что пероксид водорода выступает в роли окислителя. Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ и температуры.
2. В три пробирки налейте по 2 мл раствора пероксида водорода. В первую из пробирок внесите немного оксида кремния, во вторую — оксида марганца(IV), в третью — оксида железа(III). Что наблюдаете? Какие вещества катализируют разложение пероксида водорода? Напишите уравнение реакции разложения пероксида водорода и укажите вещества, увеличивающие скорость её протекания.
3. Положите в одну пробирку небольшое количество порошка мела, а во вторую — примерно такое же количество кусочков мрамора. В обе пробирки прилейте 10%-ю соляную кислоту. Что наблюдаете? В каком случае скорость выделения газа выше? Вспомните, что влияет на скорость гетерогенной реакции, и приведите объяснение. Напишите уравнение реакции.
4. В химическом стакане смешайте равные объёмы сильно разбавленных растворов хлорида железа(III) и роданида аммония (калия). Что наблюдаете? Напишите уравнение реакции и объясните появление окраски, предполагая, что она вызвана образованием роданида железа(III) $Fe(SCN)_3$. Данная реакция обратима. Изучите, как влияет на её положение изменение концентраций исходных веществ и продуктов. Для этого в четыре пронумерованные пробирки налейте по 2 мл полученного раствора. Первую пробирку оставьте для сравнения, добавив в неё 2 мл воды. Во вторую пробирку налейте равный объём раствора хлорида железа(III), в третью — роданида аммония, в четвёртую — концентрированный раствор хлорида аммония. Отметьте, как изменилась по сравнению с эталонной окраска в каждом случае. Результаты занесите в таблицу. Сделайте вывод о смещении положения равновесия при изменении концентраций реагентов и продуктов.
| Номер пробирки | Добавленный реагент | Изменение окраски | Причина изменения окраски |
| 1 | $H_2O$ | Эталонная окраска | – |
| 2 | $FeCl_3$ | ||
| 3 | $NH_4SCN$ | ||
| 4 | $NH_4Cl$ |
5. Налейте в пробирку несколько капель крахмального клейстера и добавьте 3 мл воды. К полученному раствору прибавьте несколько капель иодной воды до появления синей окраски. Разделите полученный раствор на две равные части. Одну из них нагрейте на пламени спиртовки. Как изменяется интенсивность окраски? Охладите раствор. Если после охлаждения окраска не достигает прежней интенсивности, внесите в пробирку несколько капель иодной воды. Синяя окраска крахмала обусловлена возникновением неустойчивого соединения с иодом. Условно представив происходящий процесс уравнением
крахмал + $I_2$ $\rightleftharpoons$ крахмал $\cdot$ $I_2$
Бесцветный Жёлтый Синий
определите знак его теплового эффекта (экзотермическая или эндотермическая реакция). Мотивируйте свой ответ.
Решение. №9 (с. 444)

Решение 2. №9 (с. 444)
1. Появление синего окрашивания свидетельствует об образовании молекулярного иода ($I_2$), который с крахмальным клейстером образует комплексное соединение синего цвета. Таким образом, крахмал выступает в роли индикатора на иод.
Уравнение реакции, в которой пероксид водорода ($H_2O_2$) является окислителем, а иодид калия ($KI$) — восстановителем:
$2KI + H_2O_2 \rightarrow I_2 \downarrow + 2KOH$
В ионной форме:
$2I^- + H_2O_2 \rightarrow I_2 \downarrow + 2OH^-$
Результаты эксперимента, занесенные в таблицу, позволяют сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ и температуры.
| Номер пробирки | Концентрация раствора KI, % | Температура раствора | Время или последовательность появления окраски | Фактор, влияющий на скорость реакции |
|---|---|---|---|---|
| 1 | 0,5 | Комнатная | 4 (медленнее всех) | - (сравнение) |
| 2 | 0,5 | Горячий раствор | 2 | Температура |
| 3 | 1,0 | Комнатная | 3 | Концентрация |
| 4 | 1,0 | Горячий раствор | 1 (быстрее всех) | Температура и концентрация |
Вывод: Скорость химической реакции увеличивается как с ростом температуры (сравнение пробирок 1 и 2; 3 и 4), так и с ростом концентрации реагирующих веществ (сравнение пробирок 1 и 3; 2 и 4). Наибольшая скорость наблюдается при максимальной температуре и концентрации (пробирка 4), а наименьшая — при минимальных (пробирка 1).
Ответ: Появление синей окраски указывает на образование иода ($I_2$). Уравнение реакции: $2KI + H_2O_2 \rightarrow I_2 + 2KOH$. Скорость реакции прямо пропорциональна температуре и концентрации реагентов.
2. При добавлении катализаторов к раствору пероксида водорода наблюдается выделение газа — кислорода. В пробирке с оксидом кремния ($SiO_2$) видимых изменений не происходит, так как он не является катализатором данной реакции. В пробирке с оксидом марганца(IV) ($MnO_2$) наблюдается очень бурное выделение газа. В пробирке с оксидом железа(III) ($Fe_2O_3$) также наблюдается выделение газа, но менее интенсивное, чем с $MnO_2$.
Вещества, катализирующие (ускоряющие) разложение пероксида водорода в данном опыте, — это оксид марганца(IV) и оксид железа(III).
Уравнение реакции разложения пероксида водорода:
$2H_2O_2 \xrightarrow{кат.} 2H_2O + O_2 \uparrow$
Вещества, увеличивающие скорость ее протекания (катализаторы): $MnO_2, Fe_2O_3$.
Ответ: Наблюдается выделение газа (кислорода) в пробирках с $MnO_2$ и $Fe_2O_3$, наиболее интенсивно с $MnO_2$. Оксид марганца(IV) и оксид железа(III) катализируют разложение пероксида водорода. Уравнение реакции: $2H_2O_2 \xrightarrow{кат.} 2H_2O + O_2 \uparrow$.
3. При добавлении соляной кислоты и к порошку мела, и к кусочкам мрамора наблюдается "вскипание" — бурное выделение углекислого газа ($CO_2$).
Скорость выделения газа значительно выше в пробирке с порошком мела.
Данная реакция является гетерогенной (реагенты находятся в разных фазах: твердой и жидкой). Скорость гетерогенной реакции зависит от площади поверхности соприкосновения реагентов. У порошка мела суммарная площадь поверхности гораздо больше, чем у кусочков мрамора той же массы. Поэтому в единицу времени большее число частиц $CaCO_3$ может прореагировать с кислотой, что и приводит к более высокой скорости реакции.
Уравнение реакции:
$CaCO_3(тв.) + 2HCl(р-р) \rightarrow CaCl_2(р-р) + H_2O(ж) + CO_2(г) \uparrow$
Ответ: В обеих пробирках выделяется газ, но с порошком мела реакция идет гораздо быстрее из-за большей площади поверхности соприкосновения реагентов. Уравнение: $CaCO_3 + 2HCl \rightarrow CaCl_2 + H_2O + CO_2 \uparrow$.
4. При смешивании растворов хлорида железа(III) и роданида аммония наблюдается появление интенсивного кроваво-красного окрашивания, что свидетельствует об образовании роданида железа(III).
Уравнение обратимой реакции в молекулярном виде:
$FeCl_3 + 3NH_4SCN \rightleftharpoons Fe(SCN)_3 + 3NH_4Cl$
В сокращенном ионном виде (отражающем суть процесса):
$Fe^{3+} + 3SCN^- \rightleftharpoons Fe(SCN)_3$
Результаты исследования влияния концентрации на смещение химического равновесия:
| Номер пробирки | Добавленный реагент | Изменение окраски | Причина изменения окраски |
|---|---|---|---|
| 1 | $H_2O$ | Эталонная окраска | - (используется для сравнения) |
| 2 | $FeCl_3$ | Усиление окраски | Увеличение концентрации реагента ($Fe^{3+}$) смещает равновесие вправо, в сторону образования продукта. |
| 3 | $NH_4SCN$ | Усиление окраски | Увеличение концентрации реагента ($SCN^−$) смещает равновесие вправо, в сторону образования продукта. |
| 4 | $NH_4Cl$ | Ослабление окраски | Ионы $Cl^−$ связывают ионы $Fe^{3+}$ в устойчивые бесцветные комплексы (напр., $[FeCl_4]^−$), уменьшая концентрацию $Fe^{3+}$ и смещая равновесие влево. |
Вывод: Согласно принципу Ле Шателье, изменение концентрации одного из веществ, участвующих в равновесии, приводит к смещению равновесия в сторону, противодействующую этому изменению. Увеличение концентрации исходных веществ смещает равновесие в сторону продуктов (вправо), а уменьшение — в сторону исходных веществ (влево).
Ответ: При смешивании реагентов образуется кроваво-красный раствор. Равновесие реакции $Fe^{3+} + 3SCN^- \rightleftharpoons Fe(SCN)_3$ смещается вправо при добавлении $FeCl_3$ или $NH_4SCN$ (окраска усиливается) и влево при добавлении $NH_4Cl$ (окраска ослабевает).
5. При нагревании раствора крахмала с иодом синяя окраска исчезает или сильно ослабевает. Это происходит потому, что комплексное соединение крахмала с иодом неустойчиво и при повышении температуры разрушается.
Наблюдения показывают, что прямая реакция образования синего комплекса является экзотермической. Знак ее теплового эффекта ($ΔH$) отрицательный ($ΔH < 0$).
Мотивация: Процесс описывается уравнением равновесия:
крахмал (бесцв.) + $I_2$ (жёлт.) $ \rightleftharpoons $ крахмал $\cdot$ $I_2$ (синий) + Q
Согласно принципу Ле Шателье, при повышении температуры равновесие смещается в сторону эндотермической реакции (той, что идет с поглощением тепла). В опыте при нагревании синяя окраска исчезает, то есть равновесие смещается влево, в сторону распада комплекса. Следовательно, обратная реакция является эндотермической, а прямая реакция (образование комплекса) — экзотермической, то есть протекает с выделением теплоты.
Ответ: Реакция образования синего комплекса крахмала с иодом является экзотермической ($ΔH < 0$), так как при нагревании, согласно принципу Ле Шателье, равновесие смещается в сторону эндотермического процесса, которым в данном случае является распад комплекса (исчезновение окраски).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 9 расположенного на странице 444 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 444), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















