Номер 5, страница 9 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Уровень обучения: базовый
Цвет обложки: белый, красный
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Вещество. Параграф 1. Атомы, молекулы, вещества - номер 5, страница 9.
№5 (с. 9)
Условие. №5 (с. 9)
скриншот условия

5. Рассчитайте мольные и массовые доли элементов, входящих в состав красного железняка $Fe_2O_3$, сернистого газа $SO_2$, известняка $CaCO_3$.
Решение. №5 (с. 9)
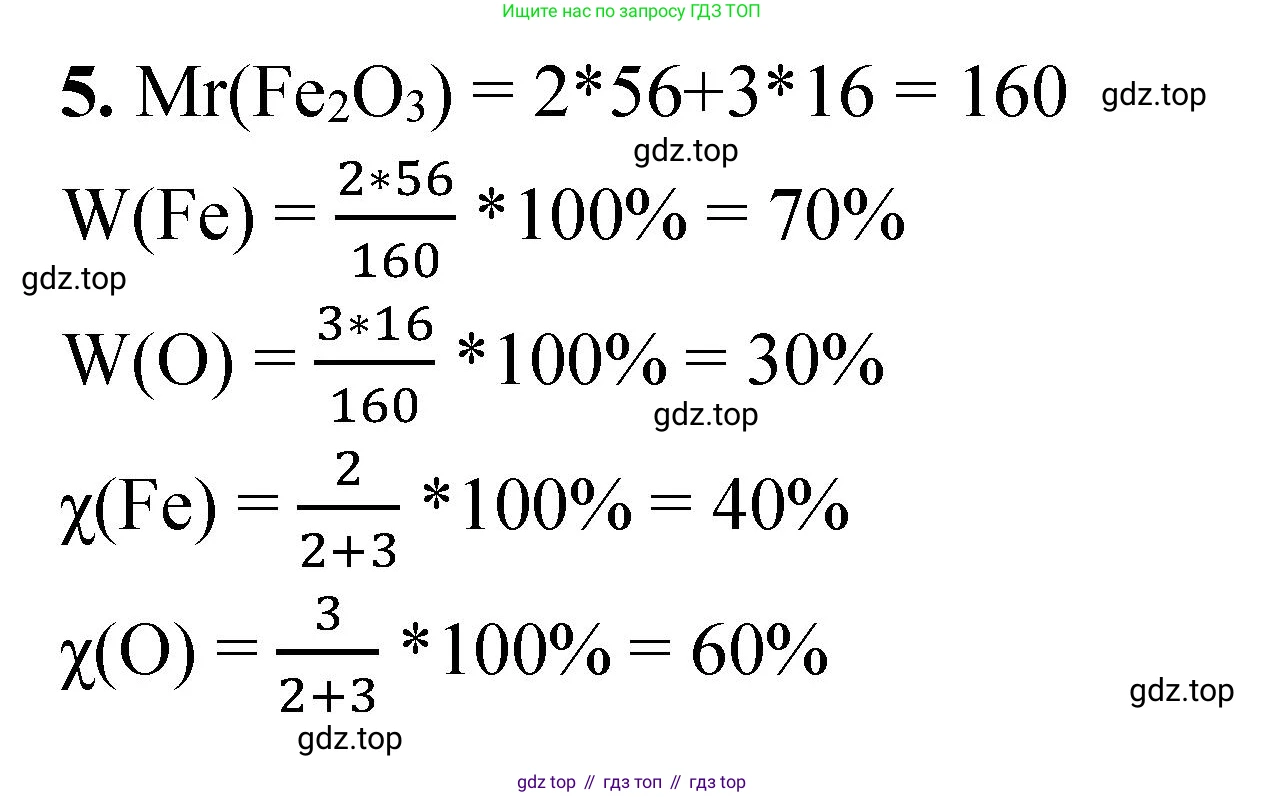
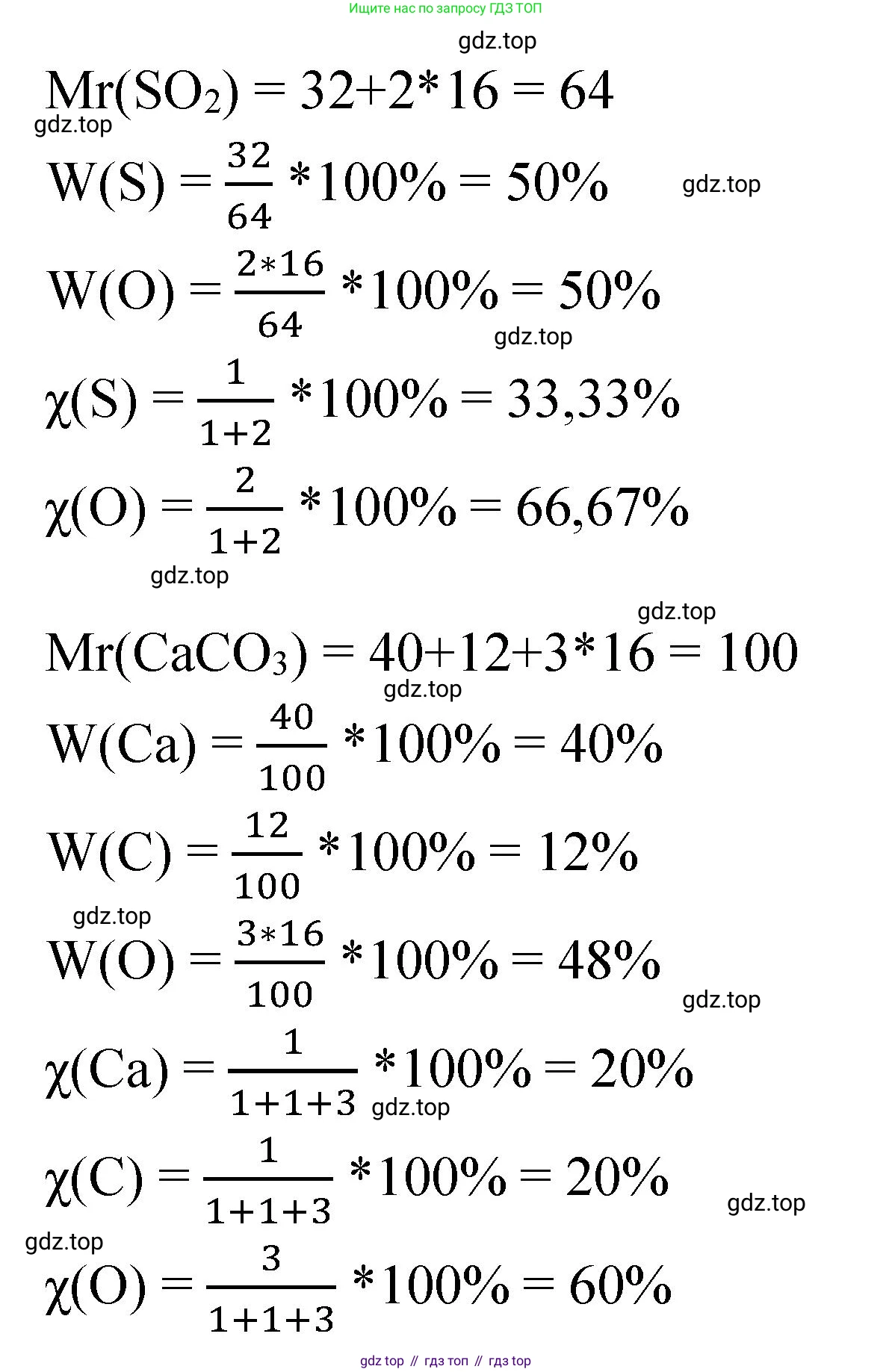
Решение 2. №5 (с. 9)
Красный железняк Fe₂O₃
Дано:
Химическая формула оксида железа(III): $Fe_2O_3$.
Для расчетов используем округленные значения относительных атомных масс ($Ar$) из периодической системы Д.И. Менделеева:
$Ar(Fe) = 56$
$Ar(O) = 16$
Относительные атомные и молекулярные массы являются безразмерными величинами, поэтому перевод в систему СИ не требуется.
Найти:
Мольные доли элементов $χ(Fe)$, $χ(O)$ и массовые доли элементов $ω(Fe)$, $ω(O)$ в $Fe_2O_3$.
Решение:
1. Расчет мольных долей элементов.
Мольная доля элемента в соединении – это отношение количества атомов данного элемента к общему числу атомов в формульной единице.
В одной формульной единице $Fe_2O_3$ содержится 2 атома железа (Fe) и 3 атома кислорода (O). Общее число атомов: $2 + 3 = 5$.
Мольная доля железа:
$χ(Fe) = \frac{2}{5} = 0.4$ или $40\%$
Мольная доля кислорода:
$χ(O) = \frac{3}{5} = 0.6$ или $60\%$
2. Расчет массовых долей элементов.
Массовая доля элемента ($ω$) вычисляется по формуле:
$ω(Э) = \frac{n \cdot Ar(Э)}{Mr(соединения)}$
где $n$ – число атомов элемента в формуле, $Ar(Э)$ – относительная атомная масса элемента, $Mr(соединения)$ – относительная молекулярная (формульная) масса соединения.
Рассчитаем относительную формульную массу $Fe_2O_3$:
$Mr(Fe_2O_3) = 2 \cdot Ar(Fe) + 3 \cdot Ar(O) = 2 \cdot 56 + 3 \cdot 16 = 112 + 48 = 160$
Рассчитаем массовую долю железа:
$ω(Fe) = \frac{2 \cdot Ar(Fe)}{Mr(Fe_2O_3)} = \frac{2 \cdot 56}{160} = \frac{112}{160} = 0.7$ или $70\%$
Рассчитаем массовую долю кислорода:
$ω(O) = \frac{3 \cdot Ar(O)}{Mr(Fe_2O_3)} = \frac{3 \cdot 16}{160} = \frac{48}{160} = 0.3$ или $30\%$
Проверка: $70\% + 30\% = 100\%$
Ответ: в красном железняке ($Fe_2O_3$) мольные доли составляют: железо – 40%, кислород – 60%; массовые доли составляют: железо – 70%, кислород – 30%.
Сернистый газ SO₂
Дано:
Химическая формула диоксида серы: $SO_2$.
Относительные атомные массы элементов:
$Ar(S) = 32$
$Ar(O) = 16$
Найти:
Мольные доли элементов $χ(S)$, $χ(O)$ и массовые доли элементов $ω(S)$, $ω(O)$ в $SO_2$.
Решение:
1. Расчет мольных долей элементов.
В одной молекуле $SO_2$ содержится 1 атом серы (S) и 2 атома кислорода (O). Общее число атомов: $1 + 2 = 3$.
Мольная доля серы:
$χ(S) = \frac{1}{3} \approx 0.333$ или $33.3\%$
Мольная доля кислорода:
$χ(O) = \frac{2}{3} \approx 0.667$ или $66.7\%$
2. Расчет массовых долей элементов.
Рассчитаем относительную молекулярную массу $SO_2$:
$Mr(SO_2) = 1 \cdot Ar(S) + 2 \cdot Ar(O) = 1 \cdot 32 + 2 \cdot 16 = 32 + 32 = 64$
Рассчитаем массовую долю серы:
$ω(S) = \frac{1 \cdot Ar(S)}{Mr(SO_2)} = \frac{1 \cdot 32}{64} = \frac{32}{64} = 0.5$ или $50\%$
Рассчитаем массовую долю кислорода:
$ω(O) = \frac{2 \cdot Ar(O)}{Mr(SO_2)} = \frac{2 \cdot 16}{64} = \frac{32}{64} = 0.5$ или $50\%$
Проверка: $50\% + 50\% = 100\%$
Ответ: в сернистом газе ($SO_2$) мольные доли составляют: сера – 33.3%, кислород – 66.7%; массовые доли составляют: сера – 50%, кислород – 50%.
Известняк CaCO₃
Дано:
Химическая формула карбоната кальция: $CaCO_3$.
Относительные атомные массы элементов:
$Ar(Ca) = 40$
$Ar(C) = 12$
$Ar(O) = 16$
Найти:
Мольные доли элементов $χ(Ca)$, $χ(C)$, $χ(O)$ и массовые доли элементов $ω(Ca)$, $ω(C)$, $ω(O)$ в $CaCO_3$.
Решение:
1. Расчет мольных долей элементов.
В одной формульной единице $CaCO_3$ содержится 1 атом кальция (Ca), 1 атом углерода (C) и 3 атома кислорода (O). Общее число атомов: $1 + 1 + 3 = 5$.
Мольная доля кальция:
$χ(Ca) = \frac{1}{5} = 0.2$ или $20\%$
Мольная доля углерода:
$χ(C) = \frac{1}{5} = 0.2$ или $20\%$
Мольная доля кислорода:
$χ(O) = \frac{3}{5} = 0.6$ или $60\%$
2. Расчет массовых долей элементов.
Рассчитаем относительную формульную массу $CaCO_3$:
$Mr(CaCO_3) = 1 \cdot Ar(Ca) + 1 \cdot Ar(C) + 3 \cdot Ar(O) = 1 \cdot 40 + 1 \cdot 12 + 3 \cdot 16 = 40 + 12 + 48 = 100$
Рассчитаем массовую долю кальция:
$ω(Ca) = \frac{1 \cdot Ar(Ca)}{Mr(CaCO_3)} = \frac{1 \cdot 40}{100} = 0.4$ или $40\%$
Рассчитаем массовую долю углерода:
$ω(C) = \frac{1 \cdot Ar(C)}{Mr(CaCO_3)} = \frac{1 \cdot 12}{100} = 0.12$ или $12\%$
Рассчитаем массовую долю кислорода:
$ω(O) = \frac{3 \cdot Ar(O)}{Mr(CaCO_3)} = \frac{3 \cdot 16}{100} = \frac{48}{100} = 0.48$ или $48\%$
Проверка: $40\% + 12\% + 48\% = 100\%$
Ответ: в известняке ($CaCO_3$) мольные доли составляют: кальций – 20%, углерод – 20%, кислород – 60%; массовые доли составляют: кальций – 40%, углерод – 12%, кислород – 48%.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 9 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 9), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), базовый уровень обучения учебного пособия издательства Просвещение.

















