Номер 5, страница 372 - гдз по химии 11 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А., Левкин А. Н.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, красный с молекулами с колбами
ISBN: 978-5-09-081245-0 (2021)
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 8. Металлы. Параграф 51. Металлы 1Б-группы: медь и серебро - номер 5, страница 372.
№5 (с. 372)
Условие. №5 (с. 372)
скриншот условия

5. Составьте уравнение реакции, используя для расстановки коэффициентов метод электронного баланса:
$PH_3 + ... + H_2O \rightarrow Ag\downarrow + ... + HNO_3$
Определите окислитель и восстановитель.
Решение. №5 (с. 372)
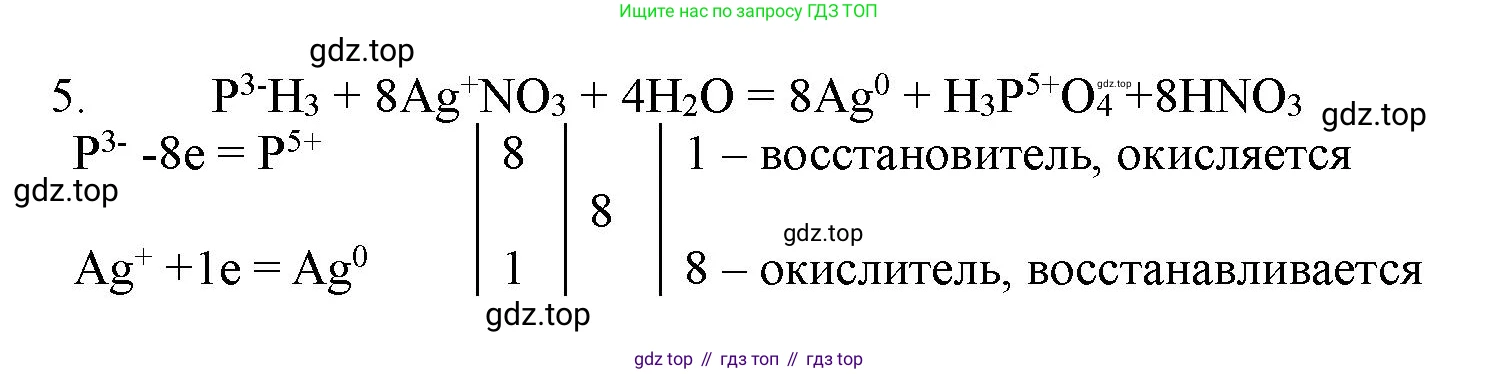
Решение 2. №5 (с. 372)
Для решения задачи необходимо сначала определить все реагенты и продукты реакции.
В продуктах реакции образуется металлическое серебро ($Ag^0$). Это указывает на то, что один из реагентов должен содержать ионы серебра, которые в ходе реакции восстанавливаются. Наиболее вероятным реагентом является нитрат серебра ($AgNO_3$), где степень окисления серебра $+1$.
Фосфин ($PH_3$) является сильным восстановителем, в котором фосфор имеет степень окисления $-3$. В продуктах присутствует азотная кислота ($HNO_3$), что указывает на кислую среду. В таких условиях фосфор окисляется до своей высшей степени окисления $+5$, образуя ортофосфорную кислоту ($H_3PO_4$).
Таким образом, полная схема реакции принимает вид:
$PH_3 + AgNO_3 + H_2O \rightarrow Ag \downarrow + H_3PO_4 + HNO_3$
Составьте уравнение реакции, используя для расстановки коэффициентов метод электронного баланса
1. Определяем степени окисления элементов, изменяющих их в ходе реакции:
$P^{-3}H_3 + Ag^{+1}NO_3 + H_2O \rightarrow Ag^{0} + H_3P^{+5}O_4 + HNO_3$
Фосфор ($\text{P}$) повышает степень окисления с $-3$ до $+5$ (окисление).
Серебро ($\text{Ag}$) понижает степень окисления с $+1$ до $\text{0}$ (восстановление).
2. Составляем электронный баланс. Число отданных электронов должно быть равно числу принятых:
$P^{-3} - 8e^{-} \rightarrow P^{+5}$ | 1 (процесс окисления)
$Ag^{+1} + 1e^{-} \rightarrow Ag^{0}$ | 8 (процесс восстановления)
Наименьшее общее кратное для чисел отданных и принятых электронов (8 и 1) равно 8. Это позволяет найти коэффициенты для окислителя и восстановителя.
3. Подставляем найденные коэффициенты (1 для веществ с $\text{P}$ и 8 для веществ с $\text{Ag}$) в уравнение реакции:
$1 PH_3 + 8 AgNO_3 + H_2O \rightarrow 8 Ag \downarrow + 1 H_3PO_4 + HNO_3$
4. Уравниваем остальные атомы.
- Азот ($\text{N}$): слева 8 атомов в $8 AgNO_3$, значит справа перед $HNO_3$ ставим коэффициент 8.
$PH_3 + 8 AgNO_3 + H_2O \rightarrow 8 Ag \downarrow + H_3PO_4 + 8 HNO_3$
- Водород ($\text{H}$): справа $\text{3}$ (в $H_3PO_4$) + $\text{8}$ (в $8 HNO_3$) = $\text{11}$ атомов. Слева $\text{3}$ атома в $PH_3$, значит из $H_2O$ нужно еще $11 - 3 = 8$ атомов. Ставим коэффициент 4 перед $H_2O$.
$PH_3 + 8 AgNO_3 + 4 H_2O \rightarrow 8 Ag \downarrow + H_3PO_4 + 8 HNO_3$
5. Проверяем уравнение по кислороду ($\text{O}$):
Слева: $8 \cdot 3 + 4 = 24 + 4 = 28$ атомов.
Справа: $4 + 8 \cdot 3 = 4 + 24 = 28$ атомов.
Баланс атомов соблюден, коэффициенты расставлены верно.
Ответ: $PH_3 + 8 AgNO_3 + 4 H_2O = 8 Ag \downarrow + H_3PO_4 + 8 HNO_3$.
Определите окислитель и восстановитель
Окислитель — вещество, атомы которого принимают электроны. В данной реакции ион серебра $Ag^{+1}$ (в составе $AgNO_3$) принимает электроны и восстанавливается до $Ag^0$.
Восстановитель — вещество, атомы которого отдают электроны. В данной реакции атом фосфора $P^{-3}$ (в составе $PH_3$) отдает электроны и окисляется до $P^{+5}$.
Ответ: Окислитель — нитрат серебра ($AgNO_3$), восстановитель — фосфин ($PH_3$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 372 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 372), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), Левкин (Антон Николаевич), углублённый уровень обучения учебного пособия издательства Просвещение.

















