Номер 13, страница 382 - гдз по химии 11 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А., Левкин А. Н.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, красный с молекулами с колбами
ISBN: 978-5-09-081245-0 (2021)
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 8. Металлы. Параграф 52. Бериллий, магний и щелочноземельные металлы - номер 13, страница 382.
№13 (с. 382)
Условие. №13 (с. 382)
скриншот условия

13. В 1 л жёсткой воды содержится 200 мг катионов кальция. Какую массу кристаллической соды $Na_2CO_3 \cdot 10H_2O$ необходимо добавить к 250 л такой воды для устранения её постоянной жёсткости?
Решение. №13 (с. 382)
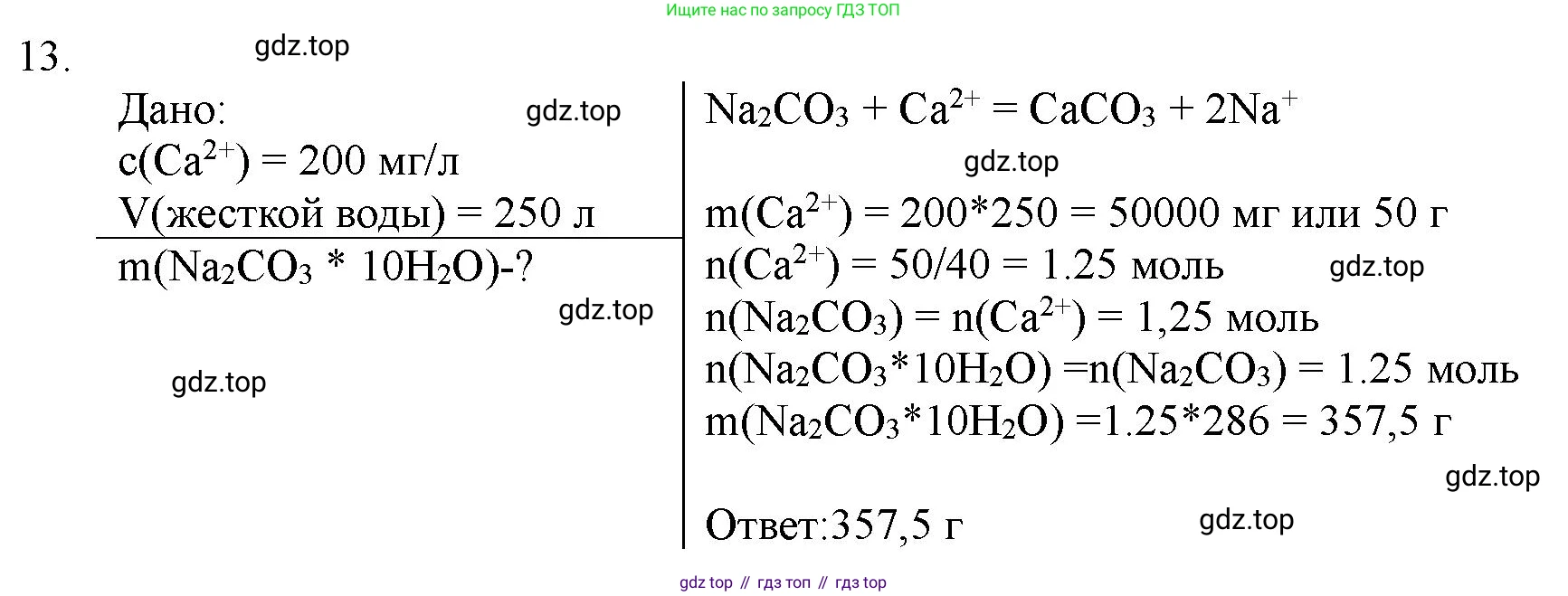
Решение 2. №13 (с. 382)
Дано:
Масса катионов кальция в 1 л воды $m_1(\text{Ca}^{2+}) = 200 \text{ мг}$
Объем воды для умягчения $V = 250 \text{ л}$
Перевод в СИ:
Массовая концентрация катионов кальция $\rho(\text{Ca}^{2+}) = 200 \text{ мг/л} = \frac{200 \cdot 10^{-6} \text{ кг}}{10^{-3} \text{ м}^3} = 0.2 \text{ кг/м}^3$.
Объем воды $V = 250 \text{ л} = 250 \cdot 10^{-3} \text{ м}^3 = 0.25 \text{ м}^3$.
Найти:
Массу кристаллической соды $m(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O})$
Решение:
1. Постоянная жёсткость воды обусловлена, в частности, присутствием катионов кальция $\text{Ca}^{2+}$. Для её устранения используют соду, которая в воде диссоциирует с образованием карбонат-ионов $\text{CO}_3^{2-}$. Эти ионы связывают катионы кальция в нерастворимый осадок карбоната кальция $\text{CaCO}_3$.
Уравнение реакции в ионной форме:
$\text{Ca}^{2+} + \text{CO}_3^{2-} \rightarrow \text{CaCO}_3\downarrow$
2. Сначала найдём общую массу катионов кальция, содержащихся в 250 л жёсткой воды.
$m_{total}(\text{Ca}^{2+}) = 200 \text{ мг/л} \cdot 250 \text{ л} = 50000 \text{ мг}$
Переведём массу в граммы:
$m_{total}(\text{Ca}^{2+}) = 50 \text{ г}$
3. Рассчитаем количество вещества (число молей) катионов кальция. Молярная масса кальция $M(\text{Ca})$ составляет примерно 40 г/моль.
$n(\text{Ca}^{2+}) = \frac{m_{total}(\text{Ca}^{2+})}{M(\text{Ca})} = \frac{50 \text{ г}}{40 \text{ г/моль}} = 1.25 \text{ моль}$
4. Из уравнения реакции следует, что для осаждения одного моля ионов $\text{Ca}^{2+}$ требуется один моль ионов $\text{CO}_3^{2-}$. Один моль кристаллической соды $\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}$ содержит один моль $\text{Na}_2\text{CO}_3$, который, в свою очередь, даёт один моль ионов $\text{CO}_3^{2-}$. Таким образом, количество вещества необходимой кристаллической соды равно количеству вещества ионов кальция.
$n(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) = n(\text{Ca}^{2+}) = 1.25 \text{ моль}$
5. Вычислим молярную массу кристаллической соды $\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}$.
$M(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) = M(\text{Na}_2\text{CO}_3) + 10 \cdot M(\text{H}_2\text{O})$
$M(\text{Na}_2\text{CO}_3) = 2 \cdot 23 + 12 + 3 \cdot 16 = 106 \text{ г/моль}$
$M(\text{H}_2\text{O}) = 2 \cdot 1 + 16 = 18 \text{ г/моль}$
$M(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) = 106 + 10 \cdot 18 = 106 + 180 = 286 \text{ г/моль}$
6. Наконец, найдём массу кристаллической соды, которую необходимо добавить к воде.
$m(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) = n(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) \cdot M(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O})$
$m(\text{Na}_2\text{CO}_3 \cdot 10\text{H}_2\text{O}) = 1.25 \text{ моль} \cdot 286 \text{ г/моль} = 357.5 \text{ г}$
Ответ: необходимо добавить 357.5 г кристаллической соды.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 13 расположенного на странице 382 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 382), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), Левкин (Антон Николаевич), углублённый уровень обучения учебного пособия издательства Просвещение.
















