Номер 5, страница 191 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2026
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава VII. Неметаллы. Параграф 42. Практическая работа 3. Решение экспериментальных задач по теме «Неметаллы» - номер 5, страница 191.
№5 (с. 191)
Условие. №5 (с. 191)
скриншот условия

5. Осуществите практические следующие превращения:
a) $CaCO_3 \rightarrow CO_2 \rightarrow CaCO_3 \rightarrow Ca(HCO_3)_2 \rightarrow CaCl_2 \rightarrow AgCl$
б) $CuO \rightarrow CuSO_4 \rightarrow BaSO_4$
$\downarrow$
$CuCl_2 \rightarrow Cu(OH)_2 \rightarrow CuO$
Решение. №5 (с. 191)
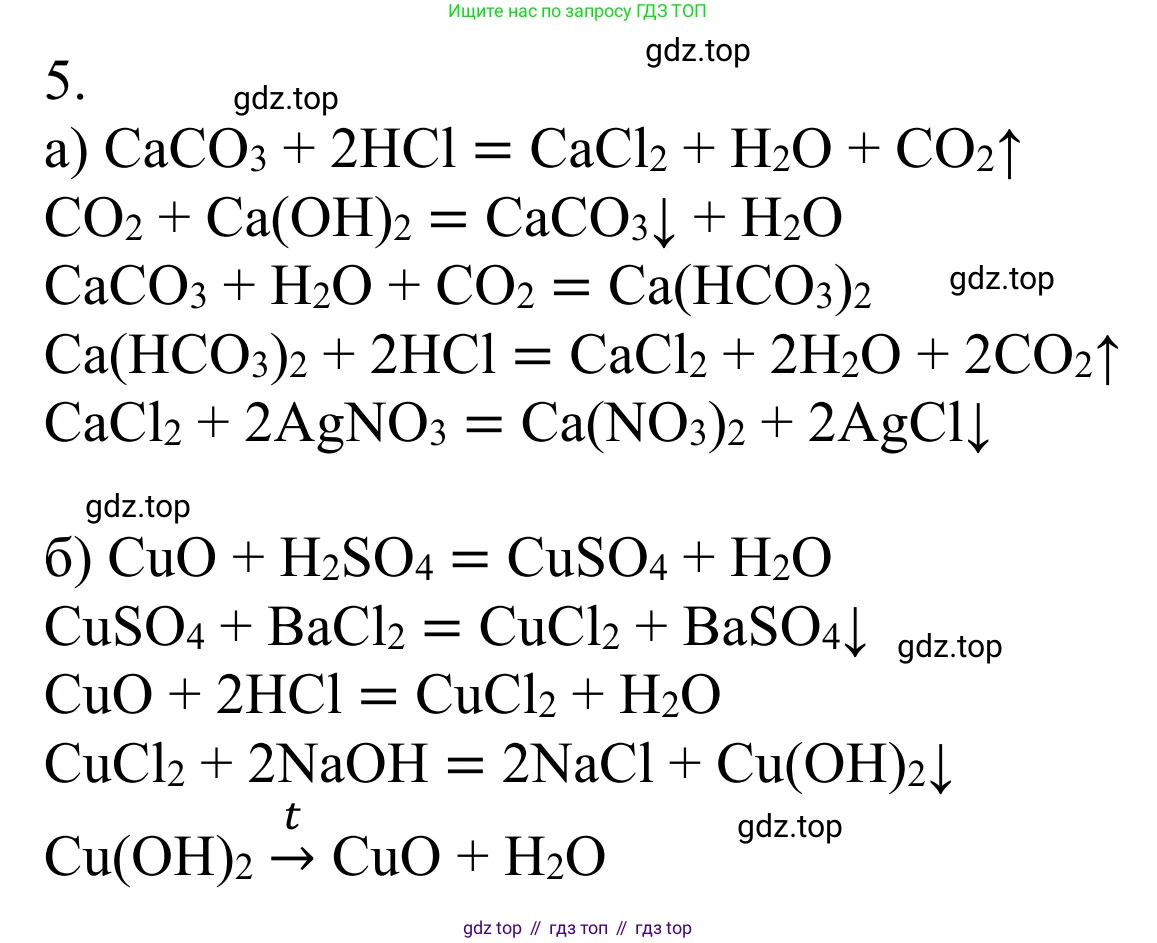
Решение 2. №5 (с. 191)
а) Для осуществления данной цепочки превращений необходимо последовательно провести следующие химические реакции:
1. $CaCO_3 \rightarrow CO_2$
Чтобы получить углекислый газ из карбоната кальция, можно провести его термическое разложение при высокой температуре (прокаливание) или подействовать на него сильной кислотой, например, соляной. Используем метод прокаливания:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2\uparrow$
2. $CO_2 \rightarrow CaCO_3$
Для обратного превращения углекислого газа в карбонат кальция необходимо пропустить $CO_2$ через раствор гидроксида кальция (известковую воду). При этом выпадает белый осадок карбоната кальция.
$CO_2 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + H_2O$
3. $CaCO_3 \rightarrow Ca(HCO_3)_2$
Карбонат кальция — нерастворимая соль, но она может реагировать с избытком углекислого газа в водной среде с образованием растворимого гидрокарбоната кальция.
$CaCO_3 + H_2O + CO_2 \rightarrow Ca(HCO_3)_2$
4. $Ca(HCO_3)_2 \rightarrow CaCl_2$
Для получения хлорида кальция из гидрокарбоната кальция необходимо добавить соляную кислоту. В результате реакции образуется соль, вода и выделяется углекислый газ.
$Ca(HCO_3)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O + 2CO_2\uparrow$
5. $CaCl_2 \rightarrow AgCl$
Это качественная реакция на ионы хлора. При добавлении к раствору хлорида кальция раствора нитрата серебра выпадает белый творожистый осадок хлорида серебра.
$CaCl_2 + 2AgNO_3 \rightarrow 2AgCl\downarrow + Ca(NO_3)_2$
Ответ:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$
$CO_2 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + H_2O$
$CaCO_3 + H_2O + CO_2 \rightarrow Ca(HCO_3)_2$
$Ca(HCO_3)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O + 2CO_2\uparrow$
$CaCl_2 + 2AgNO_3 \rightarrow 2AgCl\downarrow + Ca(NO_3)_2$
б) Для данной схемы необходимо осуществить две ветви превращений, исходящих из оксида меди(II).
Первая цепь превращений: $CuO \rightarrow CuSO_4 \rightarrow BaSO_4$
1. $CuO \rightarrow CuSO_4$
Оксид меди(II) является основным оксидом и реагирует с кислотами. Для получения сульфата меди(II) нужно провести реакцию с серной кислотой.
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
2. $CuSO_4 \rightarrow BaSO_4$
Для получения сульфата бария (нерастворимого белого осадка) к раствору сульфата меди(II) нужно добавить растворимую соль бария, например, хлорид или нитрат бария. Это качественная реакция на сульфат-ион.
$CuSO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + CuCl_2$
Вторая цепь превращений: $CuO \rightarrow CuCl_2 \rightarrow Cu(OH)_2 \rightarrow CuO$
1. $CuO \rightarrow CuCl_2$
Аналогично первой реакции, оксид меди(II) реагирует с соляной кислотой с образованием хлорида меди(II) и воды.
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
2. $CuCl_2 \rightarrow Cu(OH)_2$
Гидроксид меди(II) — нерастворимое основание. Его можно получить, добавив к раствору хлорида меди(II) раствор щелочи, например, гидроксида натрия. Выпадает голубой осадок.
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
3. $Cu(OH)_2 \rightarrow CuO$
Гидроксид меди(II) — термически неустойчивое соединение. При нагревании он разлагается на оксид меди(II) черного цвета и воду.
$Cu(OH)_2 \xrightarrow{t^\circ} CuO + H_2O$
Ответ:
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
$CuSO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + CuCl_2$
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
$Cu(OH)_2 \xrightarrow{t^\circ} CuO + H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 5 расположенного на странице 191 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 191), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















