Используя Интернет, страница 103 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава V. Электрохимические реакции. Параграф 22. Химические источники тока. Тестовые задания - страница 103.
Используя Интернет (с. 103)
Условие. Используя Интернет (с. 103)
скриншот условия

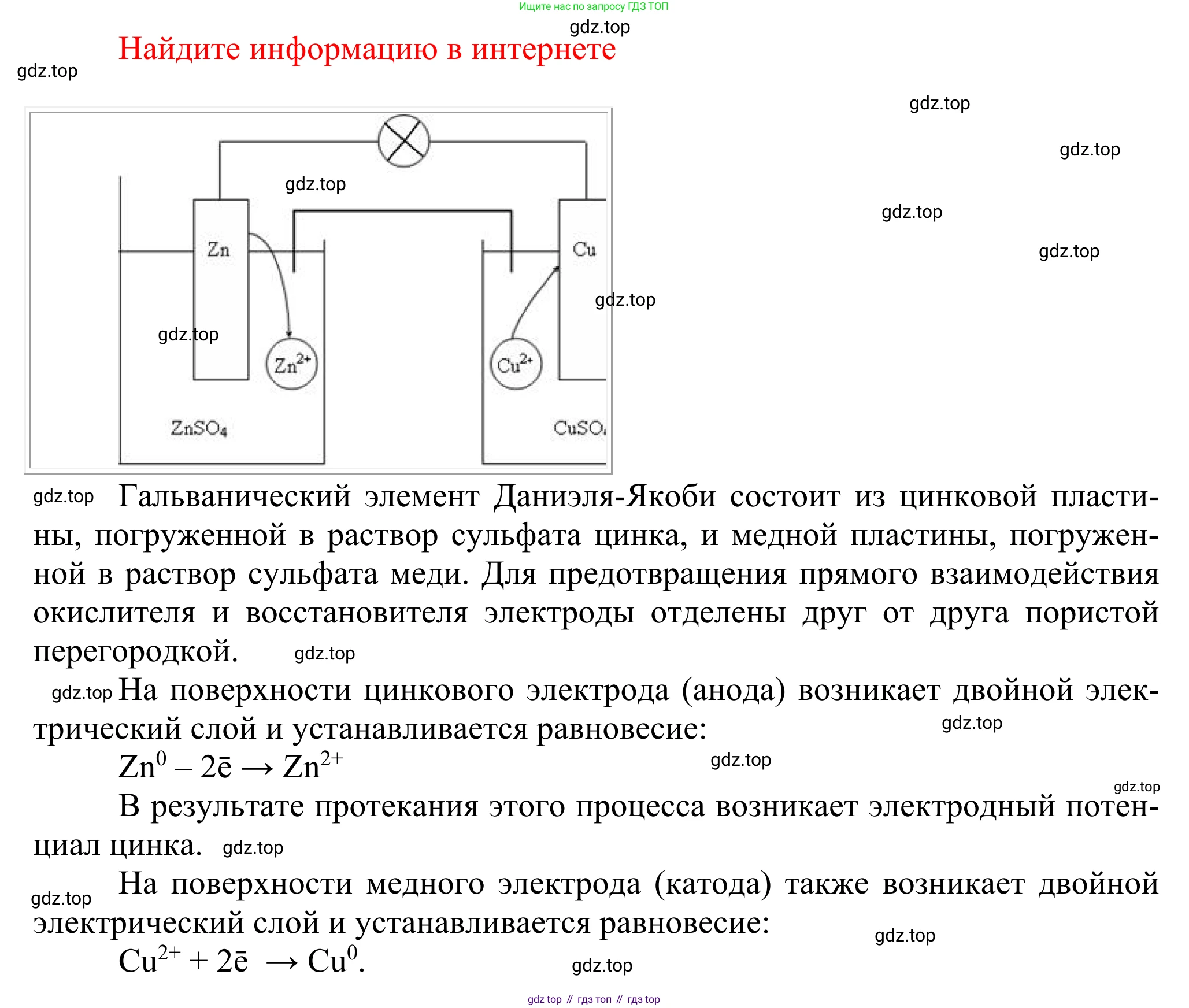
Используя дополнительные источники информации, разберитесь, как устроен гальванический элемент Даниэля—Якоби, и нарисуйте схему его работы. Обсудите результаты работы с соседом по парте. Подготовьте электронную презентацию на тему «Применение химических источников тока».
Решение. Используя Интернет (с. 103)

Решение 2. Используя Интернет (с. 103)
Устройство и принцип работы гальванического элемента Даниэля—Якоби
Решение
Гальванический элемент Даниэля—Якоби — это классический химический источник тока, преобразующий энергию химической реакции в электрическую энергию. Он был предложен английским химиком Джоном Фредериком Даниэлем в 1836 году и усовершенствован русским физиком Борисом Семёновичем Якоби.
Устройство элемента
Элемент состоит из двух полуэлементов (полуячеек), соединенных внешним проводником и солевым мостом (или разделенных пористой перегородкой).
- Отрицательный электрод (анод): Цинковая пластина ($Zn$), погруженная в раствор сульфата цинка ($ZnSO_4$).
- Положительный электрод (катод): Медная пластина ($Cu$), погруженная в раствор сульфата меди(II) ($CuSO_4$).
- Солевой мост: U-образная трубка, заполненная гелем с раствором инертной соли (например, хлорида калия $KCl$ или сульфата натрия $Na_2SO_4$). Мост соединяет два раствора, позволяя ионам перемещаться между полуэлементами для поддержания электронейтральности, но предотвращает смешивание растворов.
- Внешняя цепь: Электроды соединяются металлическим проводником, по которому движутся электроны. В цепь можно включить потребитель тока (например, вольтметр или лампочку).
Принцип работы
Работа элемента основана на окислительно-восстановительной реакции. Цинк является более активным металлом, чем медь, поэтому он легче отдает электроны (окисляется).
- На аноде (отрицательном полюсе) происходит окисление цинка. Атомы цинка с поверхности пластины отдают два электрона и переходят в раствор в виде ионов $Zn^{2+}$:
$A(-): Zn^0 - 2e^- \rightarrow Zn^{2+}$
Цинковая пластина постепенно растворяется, а концентрация ионов $Zn^{2+}$ в растворе увеличивается. Электрод приобретает отрицательный заряд из-за избытка электронов. - Электроны, освободившиеся на аноде, по внешней цепи перемещаются к катоду (положительному полюсу).
- На катоде происходит восстановление ионов меди. Ионы меди $Cu^{2+}$ из раствора сульфата меди принимают электроны и превращаются в атомы металлической меди, которые оседают на поверхности медной пластины:
$K(+): Cu^{2+} + 2e^- \rightarrow Cu^0$
Медная пластина утолщается, а концентрация ионов $Cu^{2+}$ в растворе уменьшается. - Роль солевого моста: Чтобы компенсировать изменение зарядов в растворах (избыток положительных ионов $Zn^{2+}$ у анода и недостаток положительных ионов $Cu^{2+}$ у катода), ионы из солевого моста начинают двигаться. Анионы (например, $SO_4^{2-}$) движутся в сторону анода, а катионы (например, $Na^+$) — в сторону катода, замыкая электрическую цепь и обеспечивая её непрерывную работу.
Суммарное уравнение реакции:
$Zn^0 + CuSO_4 \rightarrow ZnSO_4 + Cu^0$
Или в ионном виде:
$Zn^0 + Cu^{2+} \rightarrow Zn^{2+} + Cu^0$
Электродвижущая сила (ЭДС) такого элемента в стандартных условиях ($1$ моль/л, $25^\circ C$) составляет примерно $1,1$ В.
Схема работы элемента Даниэля—Якоби

Ответ: Гальванический элемент Даниэля—Якоби состоит из цинкового анода в растворе сульфата цинка и медного катода в растворе сульфата меди, соединенных солевым мостом. Электрический ток возникает за счет окисления цинка на аноде ($Zn - 2e^- \rightarrow Zn^{2+}$) и восстановления ионов меди на катоде ($Cu^{2+} + 2e^- \rightarrow Cu$), а электроны перемещаются по внешней цепи от цинка к меди.
Подготовьте электронную презентацию на тему «Применение химических источников тока»
Решение
Ниже представлен план-конспект для электронной презентации на заданную тему. Он включает структуру и содержание каждого слайда.
План презентации: «Применение химических источников тока»
Слайд 1: Титульный лист
- Тема: «Применение химических источников тока»
- Автор(ы): Ф.И.О.
- Учебное заведение, класс
Слайд 2: Введение
- Что такое химический источник тока (ХИТ)? Это устройство, в котором энергия химической окислительно-восстановительной реакции напрямую преобразуется в электрическую энергию.
- Классификация ХИТ:
- Первичные (гальванические элементы) – одноразовые, не подлежат перезарядке.
- Вторичные (аккумуляторы) – многоразовые, перезаряжаемые.
- Топливные элементы.
Слайд 3: Первичные источники тока (Батарейки)
- Принцип действия: необратимая химическая реакция.
- Примеры и применение:
- Солевые (марганцево-цинковые): Дешевые, для устройств с низким потреблением тока (пульты ДУ, настенные часы, простые игрушки).
- Щелочные (алкалиновые): Большая ёмкость и срок службы. Для устройств со средним и высоким потреблением (фотоаппараты, плееры, мощные фонари).
- Литиевые: Высокая плотность энергии, долгий срок хранения, работа при низких температурах. Применение: материнские платы компьютеров, кардиостимуляторы, часы, калькуляторы.
Слайд 4: Вторичные источники тока (Аккумуляторы)
- Принцип действия: обратимая химическая реакция, возможность многократной зарядки.
- Примеры и применение:
- Свинцово-кислотные: Автомобильные аккумуляторы (запуск двигателя), источники бесперебойного питания (ИБП).
- Никель-металлгидридные (Ni-MH): Электроинструменты, гибридные автомобили.
- Литий-ионные (Li-ion) и литий-полимерные (Li-Po): Доминируют на рынке портативной электроники (смартфоны, ноутбуки), электротранспорт (электромобили, дроны).
Слайд 5: Топливные элементы
- Особенность: Работают до тех пор, пока подаются реагенты (топливо и окислитель) извне.
- Пример: Водородно-кислородный топливный элемент. Реакция: $2H_2 + O_2 \rightarrow 2H_2O +$ энергия.
- Применение: Космическая отрасль (например, на МКС и в "Спейс шаттл"), резервное энергоснабжение, экологически чистый транспорт (водородные автомобили).
Слайд 6: Будущее химических источников тока
- Основные направления развития:
- Увеличение ёмкости и плотности энергии.
- Повышение безопасности (предотвращение возгораний).
- Ускорение процесса зарядки.
- Снижение стоимости и использование более доступных материалов.
- Перспективные технологии: твердотельные аккумуляторы, натрий-ионные, литий-серные.
Слайд 7: Заключение и экологические аспекты
- ХИТ — неотъемлемая часть современного мира.
- Проблема утилизации: Батарейки и аккумуляторы содержат токсичные вещества (тяжелые металлы, кислоты, щелочи). Нельзя выбрасывать с бытовым мусором.
- Важность переработки: Необходимо сдавать использованные батарейки в специальные пункты приема для безопасной утилизации и извлечения ценных компонентов.
Слайд 8: Спасибо за внимание!
- Готов(а) ответить на ваши вопросы.
Ответ: Представлен подробный пошаговый план для создания электронной презентации, охватывающий введение в химические источники тока, их классификацию, примеры применения различных типов (первичных, вторичных, топливных элементов), перспективы развития и экологические вопросы, связанные с их утилизацией.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения Используя Интернет расположенного на странице 103 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Используя Интернет (с. 103), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















