Номер 2, страница 12 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 2. Галогены - номер 2, страница 12.
№2 (с. 12)
Условие. №2 (с. 12)
скриншот условия
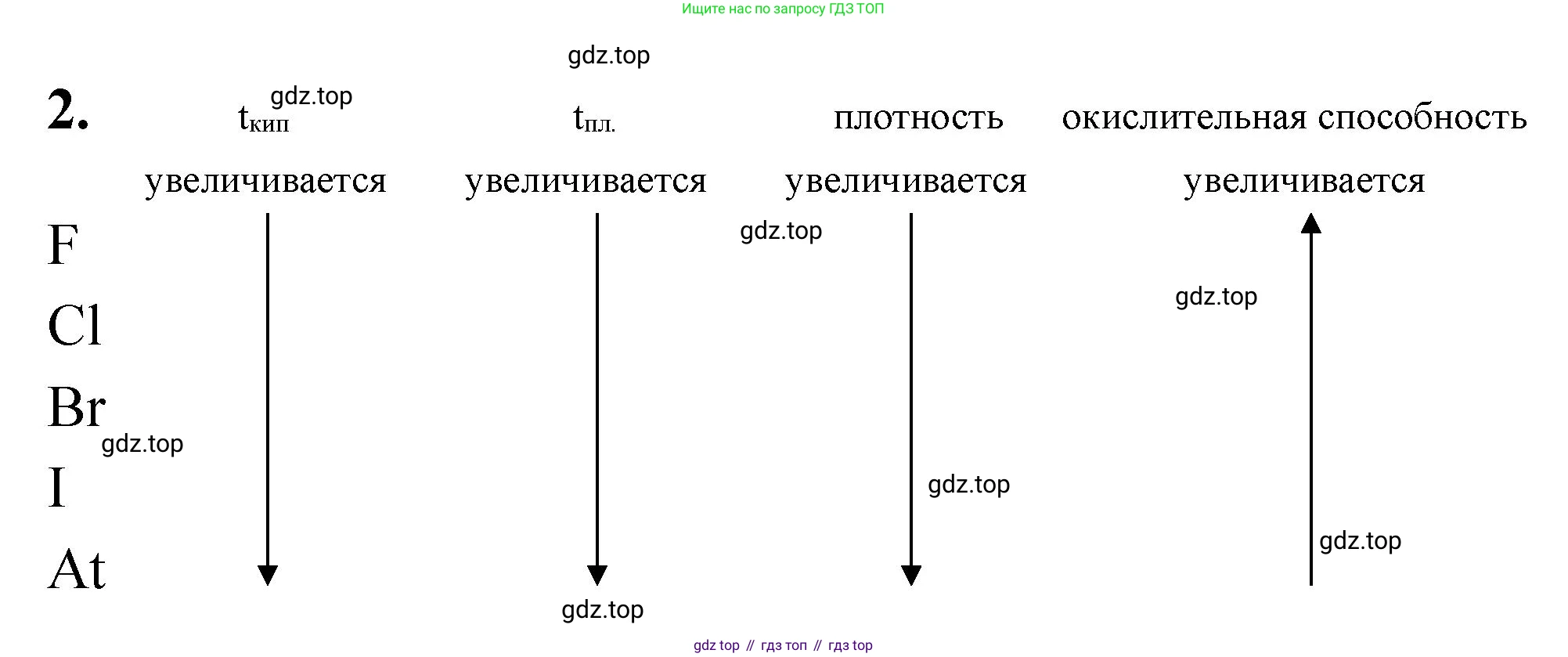
2. Охарактеризуйте галогены — простые вещества: укажите стрелками направления роста температур кипения и плавления, плотности, окислительной способности.
Решение. №2 (с. 12)
Решение 2. №2 (с. 12)
Решение
Галогены — это химические элементы 17-й группы периодической таблицы. Как простые вещества, галогены (фтор $F_2$, хлор $Cl_2$, бром $Br_2$, иод $I_2$) состоят из двухатомных молекул. Атомы в молекулах соединены ковалентной неполярной связью. Между молекулами галогенов действуют слабые межмолекулярные силы (силы Ван-дер-Ваальса, или лондоновские дисперсионные силы), которые определяют их физические свойства, такие как температуры кипения и плавления.
С увеличением порядкового номера элемента (при движении по группе сверху вниз от фтора к иоду) закономерно изменяются их физические и химические свойства.
температур кипения и плавления
С ростом порядкового номера галогена увеличивается число электронов в их молекулах и, соответственно, их молярная масса. Это приводит к усилению межмолекулярного взаимодействия. Чтобы преодолеть эти более сильные силы притяжения (для плавления или кипения вещества), требуется больше энергии. Поэтому температуры плавления и кипения закономерно возрастают в ряду от фтора к иоду. Это также объясняет изменение агрегатного состояния галогенов при стандартных условиях: фтор и хлор — газы, бром — летучая жидкость, иод — легко возгоняющиеся кристаллы.
Ответ: Направление роста температур кипения и плавления: $F_2 \rightarrow Cl_2 \rightarrow Br_2 \rightarrow I_2$.
плотности
Плотность веществ определяется отношением их массы к объему. При переходе от фтора к иоду значительно увеличивается атомная, а значит и молярная масса. Хотя атомный радиус также растет, увеличение массы является преобладающим фактором. В результате плотность галогенов (в их стандартных агрегатных состояниях) возрастает при движении по группе сверху вниз.
Ответ: Направление роста плотности: $F_2 \rightarrow Cl_2 \rightarrow Br_2 \rightarrow I_2$.
окислительной способности
Окислительная способность — это способность атомов принимать электроны. Галогены являются типичными неметаллами и сильными окислителями, так как до завершения внешнего электронного слоя им не хватает всего одного электрона. Окислительная способность тесно связана с электроотрицательностью. При движении по группе сверху вниз от фтора к иоду увеличивается атомный радиус, а внешние электроны находятся дальше от ядра и сильнее экранируются внутренними электронными слоями. Это ведет к уменьшению электроотрицательности. Следовательно, способность присоединять электроны, то есть окислительная способность, ослабевает в ряду от фтора к иоду. Фтор является самым сильным химическим окислителем.
Ответ: Направление роста окислительной способности: $I_2 \rightarrow Br_2 \rightarrow Cl_2 \rightarrow F_2$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 12 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 12), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















