Номер 10, страница 63 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 13. Серный ангидрид и серная кислота - номер 10, страница 63.
№10 (с. 63)
Условие. №10 (с. 63)
скриншот условия
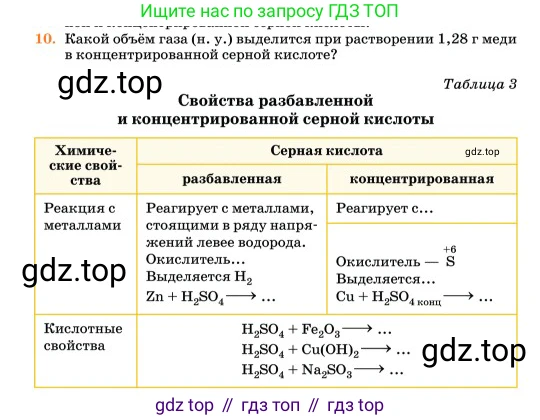
10. Какой объём газа (н. у.) выделится при растворении 1,28 г меди в концентрированной серной кислоте?
Таблица 3
Свойства разбавленной и концентрированной серной кислоты
Химические свойства
Реакция с металлами
Разбавленная: Реагирует с металлами, стоящими в ряду напряжений левее водорода. Окислитель... Выделяется $H_2$. $Zn + H_2SO_4 \rightarrow ...$
Концентрированная: Реагирует с... Окислитель — $S^{+6}$. Выделяется... $Cu + H_2SO_{4 \text{ конц}} \rightarrow ...$
Кислотные свойства
$H_2SO_4 + Fe_2O_3 \rightarrow ...$
$H_2SO_4 + Cu(OH)_2 \rightarrow ...$
$H_2SO_4 + Na_2SO_3 \rightarrow ...$
Решение. №10 (с. 63)

Решение 2. №10 (с. 63)
Дано:
$m(\text{Cu}) = 1,28 \text{ г}$
Найти:
$V(\text{газ}) - ?$
Решение:
1. Для решения задачи необходимо составить уравнение химической реакции. Согласно информации, представленной в таблице, медь реагирует с концентрированной серной кислотой. В этой реакции медь окисляется, а концентрированная серная кислота выступает в роли окислителя за счет атома серы в степени окисления $+6$, который восстанавливается. Продуктами реакции являются сульфат меди(II), оксид серы(IV) (сернистый газ) и вода.
Составим и уравняем уравнение реакции методом электронного баланса:
$Cu^0 - 2e^- \rightarrow Cu^{+2}$ | 1 (окисление)
$S^{+6} + 2e^- \rightarrow S^{+4}$ | 1 (восстановление)
Суммарное уравнение реакции:
$Cu + 2H_2SO_4 (\text{конц.}) \rightarrow CuSO_4 + SO_2 \uparrow + 2H_2O$
Газ, который выделяется в ходе реакции, — это оксид серы(IV), $SO_2$.
2. Вычислим количество вещества (моль) меди, вступившей в реакцию. Молярная масса меди $M(\text{Cu}) \approx 64 \text{ г/моль}$.
$n(\text{Cu}) = \frac{m(\text{Cu})}{M(\text{Cu})} = \frac{1,28 \text{ г}}{64 \text{ г/моль}} = 0,02 \text{ моль}$
3. Согласно уравнению реакции, из 1 моль меди образуется 1 моль оксида серы(IV). Стехиометрическое соотношение $n(\text{Cu}) : n(SO_2)$ равно $1 : 1$.
Следовательно, количество вещества выделившегося газа равно количеству вещества меди:
$n(SO_2) = n(\text{Cu}) = 0,02 \text{ моль}$
4. Рассчитаем объём выделившегося газа при нормальных условиях (н. у.). При н. у. молярный объём любого газа ($V_m$) равен 22,4 л/моль.
$V(SO_2) = n(SO_2) \cdot V_m = 0,02 \text{ моль} \cdot 22,4 \text{ л/моль} = 0,448 \text{ л}$
Ответ: объём выделившегося газа (оксида серы(IV)) при нормальных условиях составляет 0,448 л.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 10 расположенного на странице 63 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №10 (с. 63), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















