Номер 1, страница 78 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 16. Аммиак и соли аммония - номер 1, страница 78.
№1 (с. 78)
Условие. №1 (с. 78)
скриншот условия
1. Сравните физические свойства аммиака и азота.
Решение. №1 (с. 78)
Решение 2. №1 (с. 78)
1. Решение
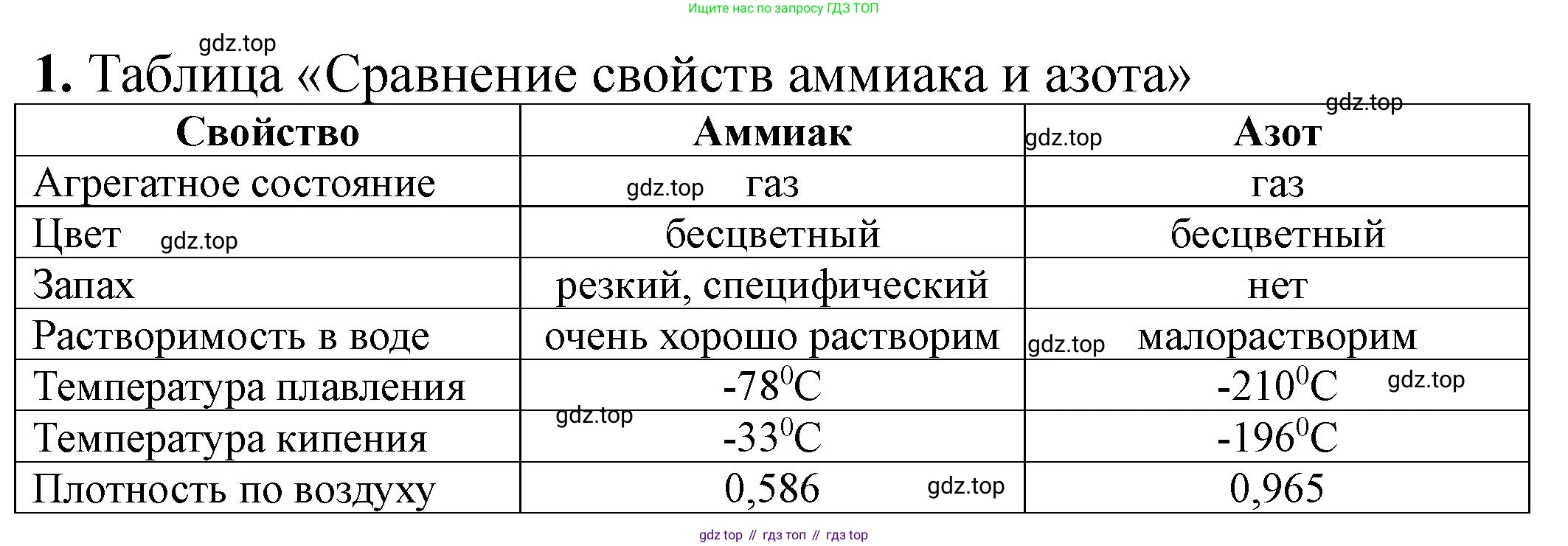
Аммиак ($NH_3$) и азот ($N_2$) — это вещества, в состав которых входит химический элемент азот, однако их физические свойства существенно различаются. Причиной этих различий является строение их молекул и, как следствие, характер межмолекулярных взаимодействий.
Агрегатное состояние, цвет и запах. При нормальных условиях и аммиак, и азот представляют собой бесцветные газы. Однако, если азот, являющийся основной составляющей воздуха, не имеет запаха, то аммиак обладает очень резким, характерным удушливым запахом (известным как запах нашатырного спирта).
Молярная масса и плотность. Молярная масса двухатомной молекулы азота ($N_2$) составляет около $28 \text{ г/моль}$, что очень близко к средней молярной массе воздуха ($\approx 29 \text{ г/моль}$). Поэтому их плотности практически одинаковы. Молярная масса аммиака ($NH_3$) равна примерно $17 \text{ г/моль}$, что делает его значительно (почти в $1.7$ раза) легче воздуха.
Растворимость в воде. Это одно из самых ярких различий. Молекула азота ($N_2$) неполярна, а связь в ней очень прочная. Взаимодействие между молекулами азота и полярными молекулами воды крайне слабое, поэтому азот практически нерастворим в воде. Молекула аммиака ($NH_3$), наоборот, является полярной (имеет форму пирамиды с атомом азота в вершине). Благодаря этому, а также наличию неподеленной электронной пары у атома азота, молекулы аммиака способны образовывать прочные водородные связи с молекулами воды. Это приводит к его чрезвычайно высокой растворимости (при $20\text{°C}$ в 1 объеме воды может раствориться до 700 объемов аммиака).
Температуры кипения и плавления. Различия в межмолекулярном взаимодействии определяют и температуры фазовых переходов. Между неполярными молекулами азота действуют только слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса). Поэтому для их преодоления и перевода вещества в жидкое состояние требуется очень низкая температура. Температура кипения азота составляет $-195.8 \text{ °C}$, а температура плавления — $-210 \text{ °C}$. В аммиаке же между молекулами существуют прочные водородные связи. Для их разрыва требуется гораздо больше энергии, что обуславливает аномально высокие для вещества с такой низкой молярной массой температуры кипения ($-33.4 \text{ °C}$) и плавления ($-77.7 \text{ °C}$).
Ответ:
Основное различие в физических свойствах аммиака и азота обусловлено строением их молекул: полярная молекула аммиака ($NH_3$) способна к образованию сильных межмолекулярных водородных связей, в то время как неполярная молекула азота ($N_2$) характеризуется лишь слабыми силами Ван-дер-Ваальса. Сравнение свойств представлено в таблице.
| Свойство | Аммиак ($NH_3$) | Азот ($N_2$) |
|---|---|---|
| Цвет | Бесцветный | Бесцветный |
| Запах | Резкий, удушливый | Без запаха |
| Плотность (относительно воздуха) | Значительно легче | Практически равна |
| Растворимость в воде | Очень высокая | Очень низкая |
| Температура кипения | $-33.4 \text{ °C}$ | $-195.8 \text{ °C}$ |
| Температура плавления | $-77.7 \text{ °C}$ | $-210 \text{ °C}$ |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 78 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 78), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















