Номер 9, страница 110 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 22. Соединения углерода - номер 9, страница 110.
№9 (с. 110)
Условие. №9 (с. 110)
скриншот условия

9. Допишите уравнения реакции и расставьте коэффициенты:
a) $Ba(OH)_2 + K_2CO_3 \rightarrow ...;$
$Ca(NO_3)_2 + Na_2CO_3 \rightarrow ...;$
$CaCO_3 \xrightarrow{t} ...;$
б) $Ca(HCO_3)_2 + Ca(OH)_2 \rightarrow CaCO_3\uparrow + ...;$
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3\downarrow + ...;$
$Cu_2(OH)_2CO_3 \xrightarrow{t} ...;$
Решение. №9 (с. 110)
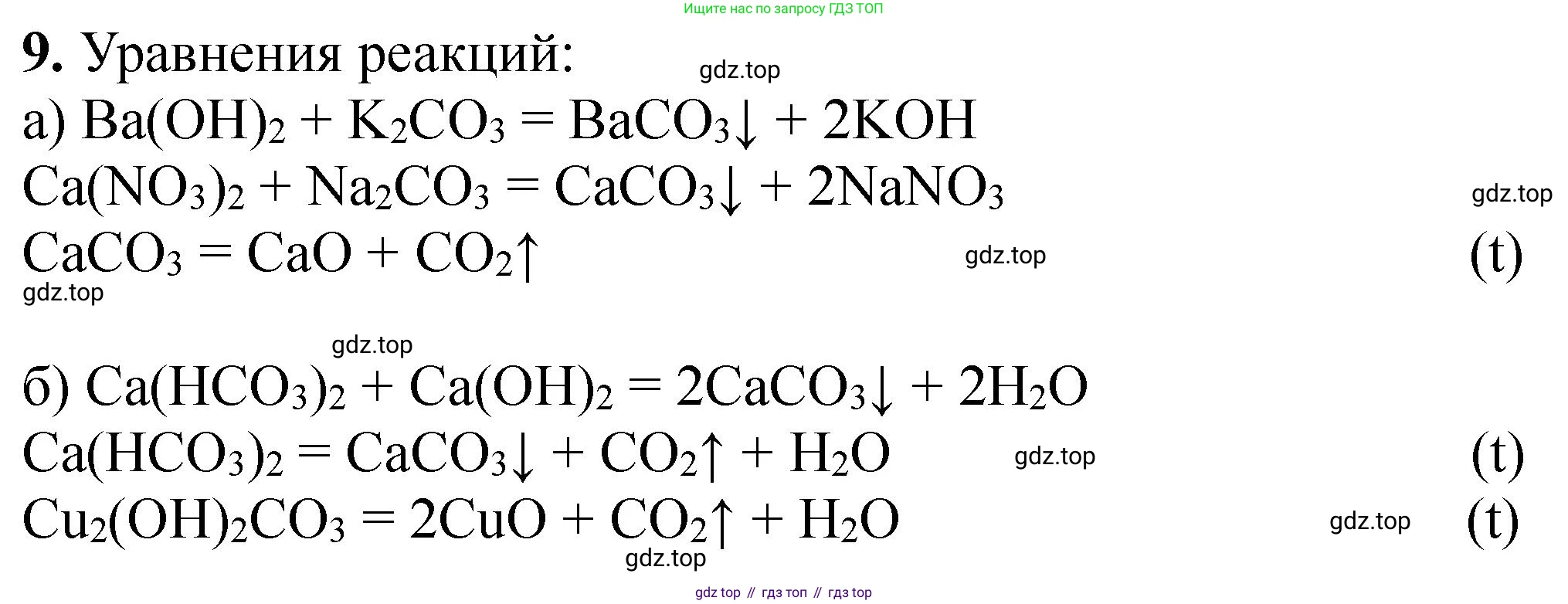
Решение 2. №9 (с. 110)
а) $Ba(OH)_2 + K_2CO_3 \rightarrow BaCO_3 \downarrow + 2KOH$
Это реакция ионного обмена между растворимым основанием (гидроксидом бария) и растворимой солью (карбонатом калия). В результате взаимодействия образуется нерастворимое в воде вещество — карбонат бария ($BaCO_3$), который выпадает в виде белого осадка, и растворимое основание — гидроксид калия ($KOH$). Для соблюдения закона сохранения массы необходимо уравнять количество атомов каждого элемента в левой и правой частях уравнения. Перед формулой гидроксида калия ставится коэффициент 2, чтобы уравнять число ионов калия ($K^+$) и гидроксид-ионов ($OH^-$).
Ответ: $Ba(OH)_2 + K_2CO_3 \rightarrow BaCO_3 \downarrow + 2KOH$
$Ca(NO_3)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaNO_3$
Это реакция ионного обмена между двумя растворимыми солями: нитратом кальция и карбонатом натрия. При смешивании их водных растворов происходит образование нерастворимого карбоната кальция ($CaCO_3$) в виде белого осадка и растворимой соли нитрата натрия ($NaNO_3$). Чтобы уравнение было сбалансированным, перед формулой нитрата натрия ставится коэффициент 2, уравнивая таким образом количество ионов натрия ($Na^+$) и нитрат-ионов ($NO_3^-$).
Ответ: $Ca(NO_3)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaNO_3$
$CaCO_3 \xrightarrow{t} CaO + CO_2 \uparrow$
Это реакция термического разложения карбоната кальция, которая протекает при сильном нагревании (около 900-1000 °C). Карбонат кальция (известняк, мел, мрамор) разлагается на оксид кальция ($CaO$, негашёная известь) и углекислый газ ($CO_2$), который выделяется в виде газа. Уравнение сбалансировано, все стехиометрические коэффициенты равны единице.
Ответ: $CaCO_3 \xrightarrow{t} CaO + CO_2 \uparrow$
б) $Ca(HCO_3)_2 + Ca(OH)_2 \rightarrow 2CaCO_3 \downarrow + 2H_2O$
Это реакция между кислой солью (гидрокарбонатом кальция) и основанием (гидроксидом кальция). В результате реакции нейтрализации образуется средняя соль — нерастворимый карбонат кальция ($CaCO_3$) и вода ($H_2O$). Данный процесс является одним из методов устранения временной (карбонатной) жесткости воды. Для баланса атомов необходимо поставить коэффициент 2 перед карбонатом кальция и водой.
Ответ: $Ca(HCO_3)_2 + Ca(OH)_2 \rightarrow 2CaCO_3 \downarrow + 2H_2O$
$Ca(HCO_3)_2 \xrightarrow{t} CaCO_3 \downarrow + H_2O + CO_2 \uparrow$
Это реакция термического разложения гидрокарбоната кальция, происходящая при нагревании (например, при кипячении воды). Гидрокарбонат кальция, обусловливающий временную жесткость воды, разлагается с образованием нерастворимого карбоната кальция ($CaCO_3$), который выпадает в осадок (накипь), воды ($H_2O$) и углекислого газа ($CO_2$). Все коэффициенты в данном уравнении равны 1.
Ответ: $Ca(HCO_3)_2 \xrightarrow{t} CaCO_3 \downarrow + H_2O + CO_2 \uparrow$
$Cu_2(OH)_2CO_3 \xrightarrow{t} 2CuO + H_2O + CO_2 \uparrow$
Это реакция термического разложения основной соли — гидроксокарбоната меди(II), известного как минерал малахит. При нагревании это соединение разлагается на оксид меди(II) ($CuO$), воду ($H_2O$) и углекислый газ ($CO_2$). Для уравнивания количества атомов меди в левой и правой частях уравнения перед формулой оксида меди(II) ставится коэффициент 2.
Ответ: $Cu_2(OH)_2CO_3 \xrightarrow{t} 2CuO + H_2O + CO_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 9 расположенного на странице 110 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 110), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















