Номер 10, страница 328 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 7. Химическая технология. Параграф 69. Научные принципы организации химического производства - номер 10, страница 328.
№10 (с. 328)
Условие. №10 (с. 328)
скриншот условия

10. Определите теоретический выход продукта при производстве извести (оксида кальция) из известняка (карбоната кальция), содержащего 5% пустой породы.
Решение. №10 (с. 328)
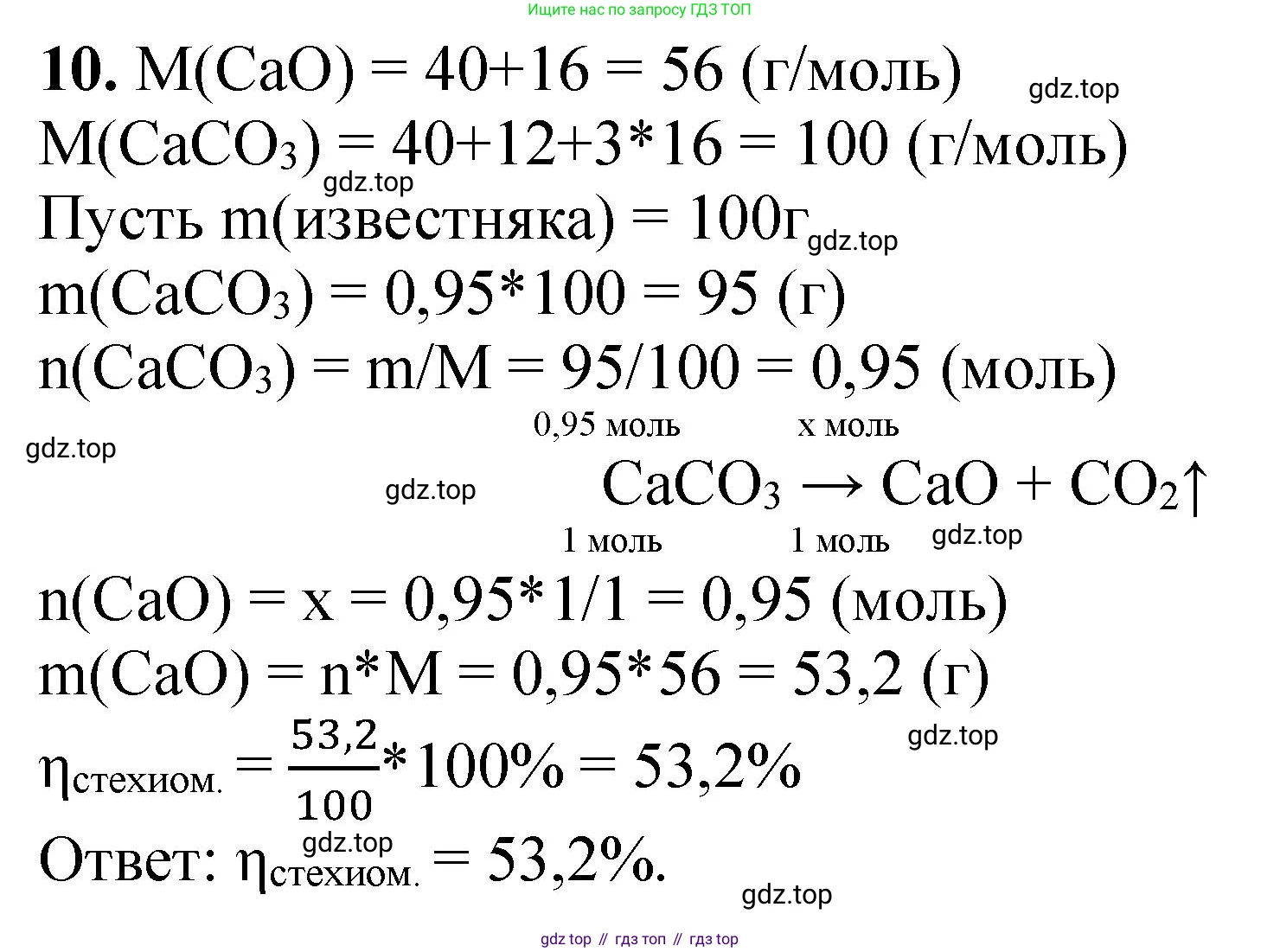
Решение 2. №10 (с. 328)
Дано:
Массовая доля примесей (пустой породы) в известняке, $\omega_{примесей} = 5\% = 0.05$.
Найти:
Теоретический выход оксида кальция, $\eta_{теор}$.
Решение:
Производство извести (оксида кальция, $CaO$) из известняка (карбоната кальция, $CaCO_3$) описывается уравнением реакции термического разложения:
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$
Из этого уравнения следует, что 1 моль $CaCO_3$ разлагается с образованием 1 моль $CaO$.
Рассчитаем молярные массы веществ, участвующих в реакции. Используем округленные значения атомных масс: $Ar(Ca) = 40$ а.е.м., $Ar(C) = 12$ а.е.м., $Ar(O) = 16$ а.е.м.
Молярная масса карбоната кальция: $M(CaCO_3) = 40 + 12 + 3 \cdot 16 = 100$ г/моль.
Молярная масса оксида кальция: $M(CaO) = 40 + 16 = 56$ г/моль.
Это означает, что из 100 г чистого карбоната кальция теоретически можно получить 56 г оксида кальция.
Далее учтем, что исходный известняк не является чистым веществом, а содержит 5% пустой породы. Следовательно, массовая доля чистого карбоната кальция в известняке составляет:
$\omega(CaCO_3) = 100\% - \omega_{примесей} = 100\% - 5\% = 95\%$, или 0.95.
Теперь мы можем рассчитать теоретический выход продукта. Теоретический выход — это отношение массы продукта, который можно получить в идеальных условиях (100% протекание реакции), к массе исходного сырья. Возьмем для расчета произвольную массу известняка, например, 100 кг.
Масса чистого $CaCO_3$ в 100 кг известняка:
$m(CaCO_3) = m_{известняка} \cdot \omega(CaCO_3) = 100 \text{ кг} \cdot 0.95 = 95 \text{ кг}$.
Составим пропорцию для нахождения массы оксида кальция ($m(CaO)$), получаемого из 95 кг чистого карбоната кальция:
Из 100 кг $CaCO_3$ — образуется 56 кг $CaO$.
Из 95 кг $CaCO_3$ — образуется $x$ кг $CaO$.
$x = m(CaO) = \frac{95 \text{ кг} \cdot 56 \text{ кг}}{100 \text{ кг}} = 53.2 \text{ кг}$.
Таким образом, из 100 кг известняка, содержащего 5% примесей, можно получить 53.2 кг оксида кальция.
Теоретический выход продукта, выраженный в процентах от массы исходного сырья, равен:
$\eta_{теор} = \frac{m(CaO)}{m_{известняка}} \cdot 100\% = \frac{53.2 \text{ кг}}{100 \text{ кг}} \cdot 100\% = 53.2\%$.
Ответ: теоретический выход продукта (оксида кальция) составляет 53,2% от массы исходного известняка.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 10 расположенного на странице 328 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №10 (с. 328), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















