Номер 6, страница 188 - гдз по химии 11 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А., Левкин А. Н.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, красный с молекулами с колбами
ISBN: 978-5-09-081245-0 (2021)
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 5. Химические реакции в водных растворах. Параграф 27. Неорганические и органические основания в свете теории электролитической диссоциации и протолитической теории - номер 6, страница 188.
№6 (с. 188)
Условие. №6 (с. 188)
скриншот условия

6. Напишите уравнения реакций, с помощью которых можно осуществить пре-вращения:
а) хлорид натрия $\to$ натрий $\to$ гидроксид натрия $\to$ карбонат натрия $\to$ сульфат натрия $\to$ гидроксид натрия;
б) карбонат кальция $\to$ оксид кальция $\to$ гидроксид кальция $\to$ гидрокарбонат кальция $\to$ нитрат кальция $\to$ нитрит кальция;
в) хлорметан $\to$ метиламин $\to$ диметиламин $\to$ гидрохлорид диметиламина.
Решение. №6 (с. 188)
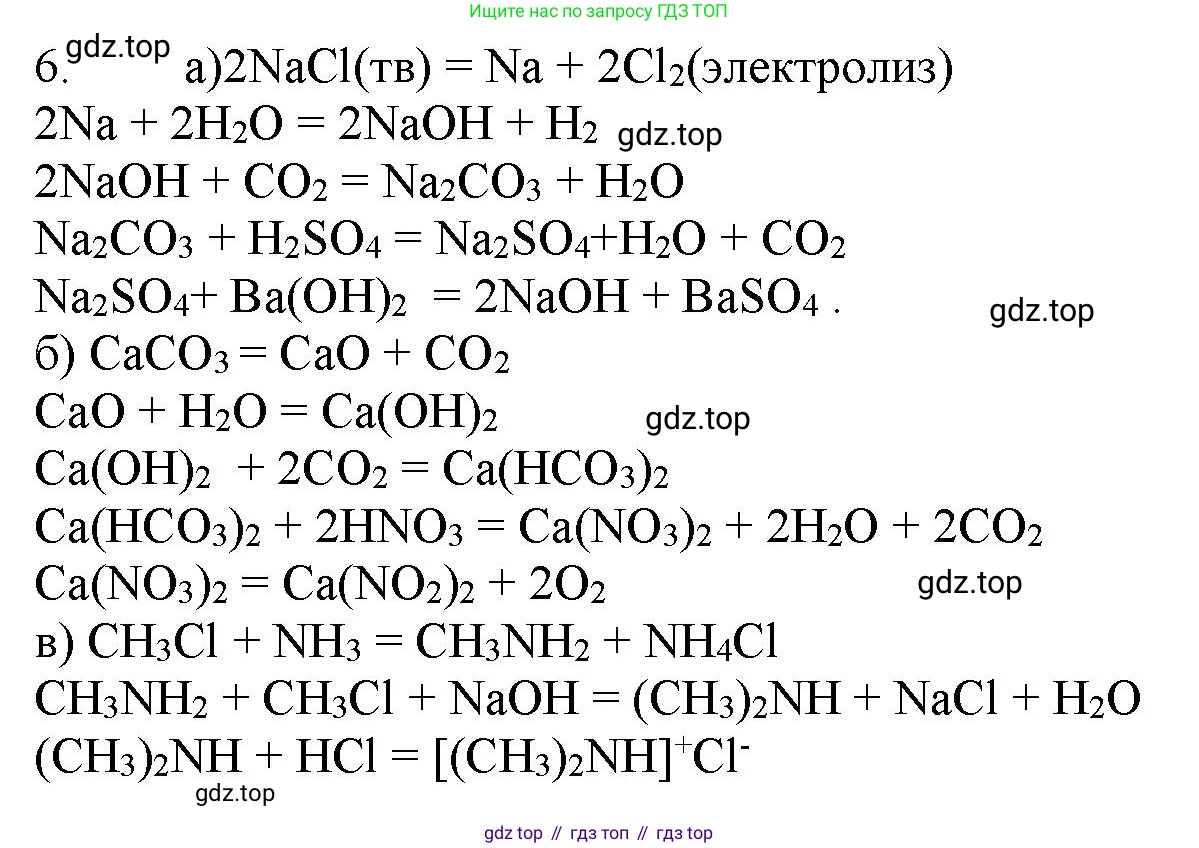
Решение 2. №6 (с. 188)
а) хлорид натрия → натрий → гидроксид натрия → карбонат натрия → сульфат натрия → гидроксид натрия;
Решение
1. Получение натрия из хлорида натрия осуществляется электролизом расплава соли:
$2NaCl \xrightarrow{электролиз\ расплава} 2Na + Cl_2 \uparrow$
2. Натрий, как активный щелочной металл, бурно реагирует с водой, образуя гидроксид натрия и водород:
$2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow$
3. Гидроксид натрия (щелочь) реагирует с кислотным оксидом углерода(IV), образуя соль карбонат натрия и воду:
$2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O$
4. Для получения сульфата натрия из карбоната натрия можно использовать реакцию с серной кислотой. Более сильная серная кислота вытесняет слабую угольную кислоту, которая разлагается на воду и углекислый газ:
$Na_2CO_3 + H_2SO_4 \rightarrow Na_2SO_4 + H_2O + CO_2 \uparrow$
5. Чтобы снова получить гидроксид натрия из сульфата натрия, можно провести реакцию ионного обмена с гидроксидом бария. В результате реакции образуется нерастворимый сульфат бария, который выпадает в осадок:
$Na_2SO_4 + Ba(OH)_2 \rightarrow 2NaOH + BaSO_4 \downarrow$
Ответ:
$2NaCl \xrightarrow{электролиз\ расплава} 2Na + Cl_2 \uparrow$
$2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow$
$2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O$
$Na_2CO_3 + H_2SO_4 \rightarrow Na_2SO_4 + H_2O + CO_2 \uparrow$
$Na_2SO_4 + Ba(OH)_2 \rightarrow 2NaOH + BaSO_4 \downarrow$
б) карбонат кальция → оксид кальция → гидроксид кальция → гидрокарбонат кальция → нитрат кальция → нитрит кальция;
Решение
1. Оксид кальция получают термическим разложением карбоната кальция (обжиг известняка):
$CaCO_3 \xrightarrow{t} CaO + CO_2 \uparrow$
2. Оксид кальция (негашеная известь) реагирует с водой с образованием гидроксида кальция (гашеной извести):
$CaO + H_2O \rightarrow Ca(OH)_2$
3. При пропускании избытка углекислого газа через раствор гидроксида кальция (известковую воду) образуется растворимая кислая соль — гидрокарбонат кальция:
$Ca(OH)_2 + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
4. Гидрокарбонат кальция реагирует с азотной кислотой, в результате чего образуется нитрат кальция, вода и выделяется углекислый газ:
$Ca(HCO_3)_2 + 2HNO_3 \rightarrow Ca(NO_3)_2 + 2H_2O + 2CO_2 \uparrow$
5. Для получения нитрита кальция из нитрата кальция можно использовать реакцию восстановления свинцом при нагревании:
$Ca(NO_3)_2 + Pb \xrightarrow{t} Ca(NO_2)_2 + PbO$
Ответ:
$CaCO_3 \xrightarrow{t} CaO + CO_2 \uparrow$
$CaO + H_2O \rightarrow Ca(OH)_2$
$Ca(OH)_2 + 2CO_2(\text{изб.}) \rightarrow Ca(HCO_3)_2$
$Ca(HCO_3)_2 + 2HNO_3 \rightarrow Ca(NO_3)_2 + 2H_2O + 2CO_2 \uparrow$
$Ca(NO_3)_2 + Pb \xrightarrow{t} Ca(NO_2)_2 + PbO$
в) хлорметан → метиламин → диметиламин → гидрохлорид диметиламина.
Решение
1. Метиламин получают в результате реакции нуклеофильного замещения хлорметана с избытком аммиака:
$CH_3Cl + 2NH_3(\text{изб.}) \rightarrow CH_3NH_2 + NH_4Cl$
2. Диметиламин образуется при дальнейшем алкилировании метиламина хлорметаном. В этой реакции метиламин выступает и как нуклеофил, и как основание для связывания образующегося хлороводорода:
$2CH_3NH_2 + CH_3Cl \rightarrow (CH_3)_2NH + [CH_3NH_3]^+Cl^-$
3. Диметиламин, являясь органическим основанием, реагирует с соляной кислотой, образуя соль — гидрохлорид диметиламина (хлорид диметиламмония):
$(CH_3)_2NH + HCl \rightarrow [(CH_3)_2NH_2]^+Cl^-$
Ответ:
$CH_3Cl + 2NH_3(\text{изб.}) \rightarrow CH_3NH_2 + NH_4Cl$
$2CH_3NH_2 + CH_3Cl \rightarrow (CH_3)_2NH + [CH_3NH_3]^+Cl^-$
$(CH_3)_2NH + HCl \rightarrow [(CH_3)_2NH_2]^+Cl^-$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 6 расположенного на странице 188 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 188), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), Левкин (Антон Николаевич), углублённый уровень обучения учебного пособия издательства Просвещение.

















