Номер 2, страница 145 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава VI. Металлы. Параграф 31. Титан и хром. Подумайте, ответьте, выполните... - номер 2, страница 145.
№2 (с. 145)
Условие. №2 (с. 145)
скриншот условия

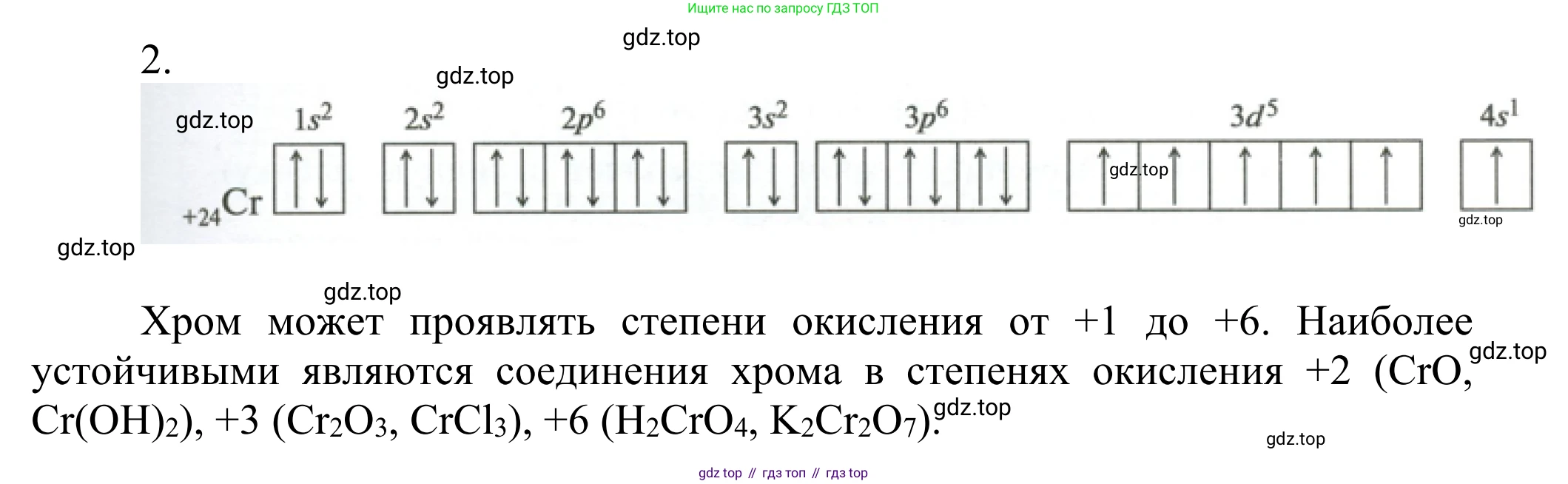
2. Какие степени окисления характерны для хрома в его соединениях? Приведите примеры. Составьте схему размещения электронов по орбиталям в атоме хрома.
Решение. №2 (с. 145)
Решение 2. №2 (с. 145)
Характерные степени окисления хрома и их примеры
Хром ($Cr$) — это переходный металл, который способен проявлять в своих соединениях несколько различных степеней окисления. Наиболее важными и распространенными являются +2, +3 и +6.
- Степень окисления +2 ($Cr^{2+}$): Соединения двухвалентного хрома являются сильными восстановителями и проявляют основные свойства. Они неустойчивы на воздухе и легко окисляются до соединений $Cr^{3+}$.
Примеры: оксид хрома(II) — $CrO$, гидроксид хрома(II) — $Cr(OH)_2$, хлорид хрома(II) — $CrCl_2$. - Степень окисления +3 ($Cr^{3+}$): Это наиболее устойчивая степень окисления для хрома. Соединения трехвалентного хрома обладают амфотерными свойствами, то есть могут реагировать как с кислотами, так и со щелочами.
Примеры: оксид хрома(III) — $Cr_2O_3$, гидроксид хрома(III) — $Cr(OH)_3$, сульфат хрома(III) — $Cr_2(SO_4)_3$. - Степень окисления +6 ($Cr^{6+}$): Соединения шестивалентного хрома проявляют кислотные свойства и являются сильными окислителями, особенно в кислой среде.
Примеры: оксид хрома(VI) — $CrO_3$ (хромовый ангидрид), хроматы (например, хромат калия $K_2CrO_4$) и дихроматы (например, дихромат калия $K_2Cr_2O_7$).
Также хром может иметь и другие степени окисления, например, 0 в металлоорганических соединениях, таких как гексакарбонил хрома $Cr(CO)_6$.
Ответ: Наиболее характерными для хрома в его соединениях являются степени окисления +2, +3 и +6.
Схема размещения электронов по орбиталям в атоме хрома
Атом хрома ($Cr$) имеет порядковый номер 24 в периодической системе, следовательно, заряд его ядра составляет +24, а в нейтральном атоме содержится 24 электрона.
При заполнении электронных оболочек у хрома наблюдается явление, известное как "провал" или "проскок" электрона. Для достижения более энергетически выгодного состояния один электрон с 4s-подуровня переходит на 3d-подуровень. В результате атом хрома имеет наполовину заполненные 4s- и 3d-подуровни, что придает ему дополнительную устойчивость.
Полная электронная конфигурация атома хрома выглядит следующим образом:
$ {}_{24}Cr \quad 1s^2 2s^2 2p^6 3s^2 3p^6 3d^5 4s^1 $
Электронно-графическая схема для валентных электронов (электронов внешнего и предвнешнего уровней) имеет вид:
↑ ↑ ↑ ↑ ↑
3d⁵
↑
4s¹
На данной схеме видно, что у атома хрома есть шесть неспаренных электронов: один на 4s-орбитали и пять на 3d-орбиталях.
Ответ: Электронная формула атома хрома — $1s^2 2s^2 2p^6 3s^2 3p^6 3d^5 4s^1$. Электронно-графическая схема валентных слоев показывает наличие одного неспаренного электрона на 4s-подуровне и пяти неспаренных электронов на 3d-подуровне.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 2 расположенного на странице 145 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 145), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.
















