Номер 2, страница 145 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 28. Азот. Вопросы и задания - номер 2, страница 145.
№2 (с. 145)
Условие. №2 (с. 145)
скриншот условия

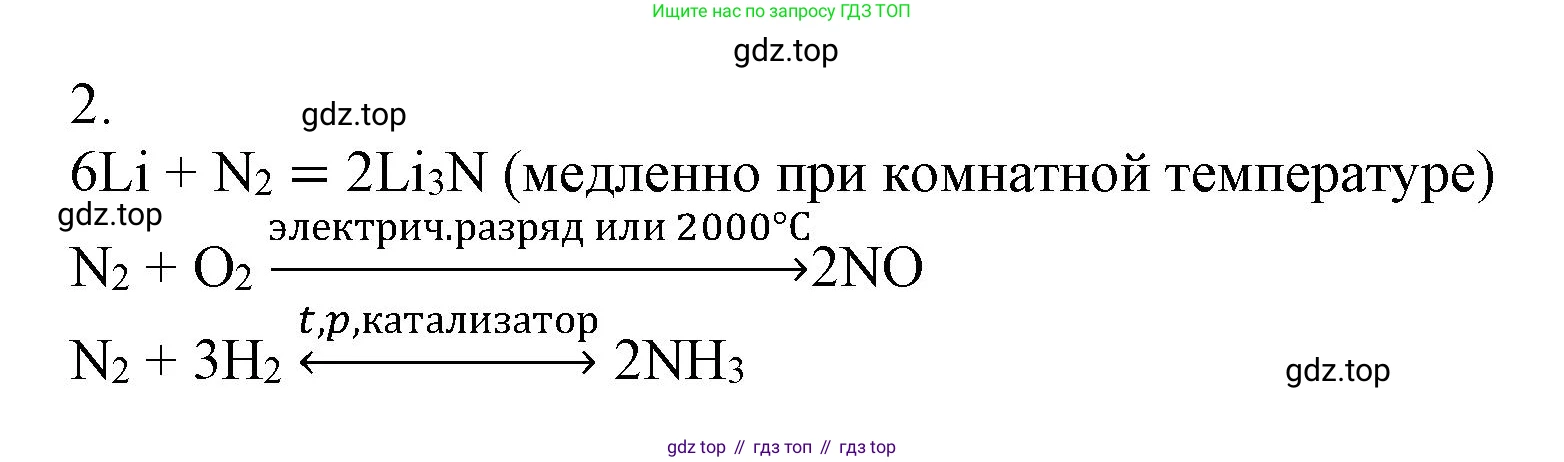
2. При взаимодействии азота с кислородом образуется оксид азота(II), при взаимодействии азота с водородом — аммиак $NH_3$, а при взаимодействии азота с литием — нитрид лития $Li_3N$. Напишите уравнения реакций, укажите условия их протекания. В каких случаях азот выступает как окислитель, а в каком — как восстановитель?
Решение. №2 (с. 145)
Решение 2. №2 (с. 145)
При взаимодействии азота с кислородом
Уравнение реакции взаимодействия азота с кислородом с образованием оксида азота(II):
$N_2 + O_2 \rightleftharpoons 2NO$
Условия протекания реакции: данная реакция является сильно эндотермической, поэтому для её осуществления требуется очень высокая температура (около 2000-3000 °C) или электрический разряд (например, во время грозы).
Определение роли азота: в виде простого вещества ($N_2$) азот имеет степень окисления 0. В соединении, оксиде азота(II) ($NO$), кислород имеет степень окисления -2, следовательно, степень окисления азота равна +2. Так как степень окисления азота повышается с 0 до +2, он отдает электроны и выступает в роли восстановителя.
Процесс окисления: $N^0 - 2e^- \rightarrow N^{+2}$.
Ответ: Уравнение: $N_2 + O_2 \rightleftharpoons 2NO$; условия: t > 2000°C или электрический разряд; азот является восстановителем.
При взаимодействии азота с водородом
Уравнение реакции взаимодействия азота с водородом с образованием аммиака:
$N_2 + 3H_2 \rightleftharpoons 2NH_3$
Условия протекания реакции: это обратимая экзотермическая реакция (процесс Габера-Боша), для смещения равновесия в сторону образования продукта используют катализатор (пористое железо с оксидами алюминия и калия), высокое давление (15-35 МПа) и повышенную температуру (400-500 °C).
Определение роли азота: в простом веществе ($N_2$) степень окисления азота равна 0. В аммиаке ($NH_3$) водород имеет степень окисления +1, следовательно, степень окисления азота равна -3. Так как степень окисления азота понижается с 0 до -3, он принимает электроны и выступает в роли окислителя.
Процесс восстановления: $N^0 + 3e^- \rightarrow N^{-3}$.
Ответ: Уравнение: $N_2 + 3H_2 \rightleftharpoons 2NH_3$; условия: катализатор, высокое давление, повышенная температура; азот является окислителем.
При взаимодействии азота с литием
Уравнение реакции взаимодействия азота с литием с образованием нитрида лития:
$6Li + N_2 \rightarrow 2Li_3N$
Условия протекания реакции: литий — очень активный щелочной металл, он способен реагировать с азотом воздуха уже при комнатной температуре. Для ускорения реакции обычно применяют небольшое нагревание.
Определение роли азота: в простом веществе ($N_2$) степень окисления азота равна 0. В нитриде лития ($Li_3N$), как и в других ионных нитридах, степень окисления азота равна -3 (литий имеет постоянную степень окисления +1). Так как степень окисления азота понижается с 0 до -3, он принимает электроны и выступает в роли окислителя.
Процесс восстановления: $N^0 + 3e^- \rightarrow N^{-3}$.
Ответ: Уравнение: $6Li + N_2 \rightarrow 2Li_3N$; условия: комнатная температура или нагревание; азот является окислителем.
В каких случаях азот выступает как окислитель, а в каком — как восстановитель?
Азот проявляет двойственную окислительно-восстановительную природу. Он выступает как окислитель в реакциях с менее электроотрицательными элементами, такими как металлы (литий) и водород. В этих случаях азот принимает электроны, понижая свою степень окисления. Он выступает как восстановитель в реакциях с более электроотрицательными элементами, такими как кислород (или фтор). В этих случаях азот отдает электроны, повышая свою степень окисления.
Ответ: Азот выступает как окислитель в реакциях с водородом и литием, а как восстановитель — в реакции с кислородом.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 145 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 145), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















