Номер 14, страница 52 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства оснований как электролитов. Вариант 3 - номер 14, страница 52.
№14 (с. 52)
Условие. №14 (с. 52)
скриншот условия

14. Гидроксид кальция (гашёную известь) применяют при строительных работах, известковании почв, дублении кожи, для смягчения воды и нейтрализации кислотных сточных вод. Напишите пример уравнения реакции нейтрализации гашёной извести в молекулярной и ионной форме.
Решение. №14 (с. 52)

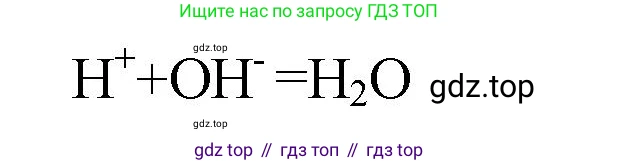
Решение 2. №14 (с. 52)
Решение
Реакция нейтрализации – это реакция между кислотой и основанием, в результате которой образуются соль и вода. Гидроксид кальция $Ca(OH)_2$, или гашёная известь, является основанием. Для написания уравнения реакции нейтрализации необходимо выбрать кислоту. В качестве примера возьмем соляную (хлороводородную) кислоту ($HCl$), которая может содержаться в кислотных сточных водах.
Уравнение в молекулярной форме
При взаимодействии гидроксида кальция с соляной кислотой образуются соль (хлорид кальция, $CaCl_2$) и вода ($H_2O$). Запишем и сбалансируем уравнение реакции, чтобы число атомов каждого элемента в левой и правой частях было одинаковым.
$$ Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O $$
Уравнения в ионной форме
Для составления ионных уравнений необходимо учесть растворимость и степень диссоциации веществ.
• Гидроксид кальция $Ca(OH)_2$ – малорастворимое в воде вещество (основание), поэтому в ионных уравнениях его принято записывать в молекулярном виде с указанием твердого состояния (тв).
• Соляная кислота $HCl$ – сильная кислота, в водном растворе полностью диссоциирует на ионы водорода $H^+$ и хлорид-ионы $Cl^-$.
• Хлорид кальция $CaCl_2$ – растворимая соль, в растворе диссоциирует на ионы кальция $Ca^{2+}$ и хлорид-ионы $Cl^-$.
• Вода $H_2O$ – очень слабый электролит, записывается в молекулярном виде.
Полное ионное уравнение включает все ионы, образующиеся в растворе, и недиссоциирующие вещества:
$$ Ca(OH)_2(тв) + 2H^+ + 2Cl^- \rightarrow Ca^{2+} + 2Cl^- + 2H_2O $$
Сокращенное ионное уравнение получается после исключения из полного ионного уравнения одинаковых ионов (ионов-наблюдателей), присутствующих в обеих его частях. В данном случае это хлорид-ионы ($2Cl^-$). Сокращенное ионное уравнение отражает суть химического взаимодействия.
$$ Ca(OH)_2(тв) + 2H^+ \rightarrow Ca^{2+} + 2H_2O $$
Ответ:
Пример уравнения реакции нейтрализации гашёной извести ($Ca(OH)_2$) соляной кислотой ($HCl$):
Молекулярная форма: $ Ca(OH)_2 + 2HCl \rightarrow CaCl_2 + 2H_2O $
Ионная форма (сокращенное уравнение): $ Ca(OH)_2(тв) + 2H^+ \rightarrow Ca^{2+} + 2H_2O $
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 14 расположенного на странице 52 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №14 (с. 52), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















