Номер 13, страница 60 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства солей как электролитов. Вариант 3 - номер 13, страница 60.
№13 (с. 60)
Условие. №13 (с. 60)
скриншот условия

13. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$CaO$ → $Ca(OH)_2$ → $CaCl_2$ → $CaCO_3$
Для одной из реакций ионного обмена напишите сокращённое ионное уравнение.
Решение. №13 (с. 60)
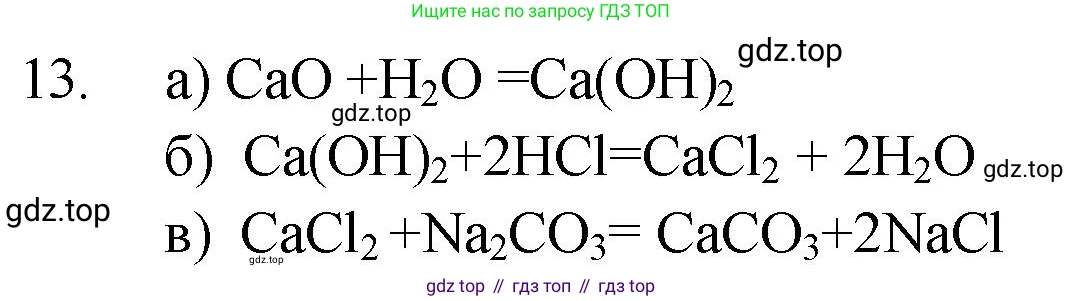
Решение 2. №13 (с. 60)
Для осуществления данной цепи превращений необходимо провести следующие реакции:
CaO → Ca(OH)₂
Чтобы получить гидроксид кальция из оксида кальция, необходимо добавить воду. Оксид кальция, как основный оксид, вступает в реакцию соединения с водой, образуя соответствующее основание — гидроксид кальция (гашёную известь).
$CaO + H₂O → Ca(OH)₂$
Ответ: $CaO + H₂O → Ca(OH)₂$
Ca(OH)₂ → CaCl₂
Для получения соли (хлорида кальция) из основания (гидроксида кальция) необходимо провести реакцию нейтрализации с кислотой, содержащей нужный кислотный остаток. В данном случае это соляная кислота (HCl). Это реакция ионного обмена.
$Ca(OH)₂ + 2HCl → CaCl₂ + 2H₂O$
Ответ: $Ca(OH)₂ + 2HCl → CaCl₂ + 2H₂O$
CaCl₂ → CaCO₃
Чтобы получить нерастворимый карбонат кальция из растворимого хлорида кальция, нужно провести реакцию ионного обмена с веществом, содержащим карбонат-ион ($CO₃^{2-}$), например, с растворимой солью — карбонатом натрия (Na₂CO₃). В результате реакции выпадает белый осадок карбоната кальция.
$CaCl₂ + Na₂CO₃ → CaCO₃↓ + 2NaCl$
Ответ: $CaCl₂ + Na₂CO₃ → CaCO₃↓ + 2NaCl$
Сокращенное ионное уравнение
В данной цепи две последние реакции являются реакциями ионного обмена. Напишем сокращенное ионное уравнение для последней реакции, которая представляет собой реакцию обмена между двумя солями с образованием нерастворимого продукта (осадка).
Молекулярное уравнение реакции:
$CaCl₂ + Na₂CO₃ → CaCO₃↓ + 2NaCl$
Полное ионное уравнение, в котором сильные растворимые электролиты ($CaCl₂$, $Na₂CO₃$, $NaCl$) записаны в виде ионов, а нерастворимое вещество ($CaCO₃$) — в молекулярном виде:
$Ca^{2+} + 2Cl^{-} + 2Na^{+} + CO₃^{2-} → CaCO₃↓ + 2Na^{+} + 2Cl^{-}$
Сокращенное ионное уравнение получается после исключения ионов-наблюдателей ($2Na^{+}$ и $2Cl^{-}$), которые присутствуют в обеих частях уравнения:
$Ca^{2+} + CO₃^{2-} → CaCO₃↓$
Ответ: $Ca^{2+} + CO₃^{2-} → CaCO₃↓$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 60 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 60), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















