Номер 12, страница 169 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Контрольные работы. Неметаллы. Вариант 3 - номер 12, страница 169.
№12 (с. 169)
Условие. №12 (с. 169)
скриншот условия

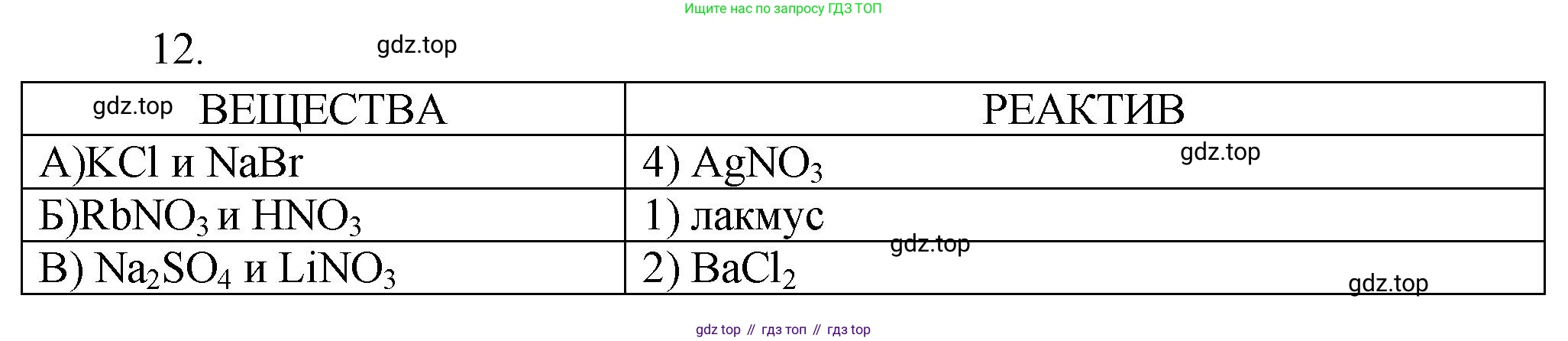
12. Установите соответствие между веществами и реактивом, с помощью которого их можно различить.
ВЕЩЕСТВА
РЕАКТИВ
А) $KCl$ и $NaBr$
1) лакмус
Б) $RbNO_3$ и $HNO_3$
2) $CuSO_4$
В) $Na_2SO_4$ и $LiNO_3$
3) $BaCl_2$
4) $AgNO_3$
Решение. №12 (с. 169)
Решение 2. №12 (с. 169)
А) KCl и NaBr
Решение
Чтобы различить растворы хлорида калия ($KCl$) и бромида натрия ($NaBr$), нужно найти реагент, который по-разному взаимодействует с анионами $Cl^-$ и $Br^-$. Из предложенных вариантов подходит нитрат серебра ($AgNO_3$), который является качественным реактивом на галогенид-ионы. При взаимодействии с хлоридом калия образуется белый творожистый осадок хлорида серебра:
$KCl + AgNO_3 \rightarrow AgCl\downarrow + KNO_3$
При взаимодействии с бромидом натрия образуется светло-желтый осадок бромида серебра:
$NaBr + AgNO_3 \rightarrow AgBr\downarrow + NaNO_3$
По разнице в цвете образующихся осадков можно отличить одно вещество от другого.
Ответ: 4
Б) RbNO₃ и HNO₃
Решение
В этой паре нужно различить соль, нитрат рубидия ($RbNO_3$), и сильную кислоту, азотную кислоту ($HNO_3$). Раствор соли $RbNO_3$, образованной сильным основанием ($RbOH$) и сильной кислотой ($HNO_3$), имеет нейтральную среду ($pH \approx 7$). Раствор азотной кислоты имеет кислую среду ($pH < 7$). Различить растворы с разной кислотностью можно с помощью кислотно-основного индикатора, например, лакмуса. В нейтральном растворе $RbNO_3$ лакмус будет фиолетовым, а в кислом растворе $HNO_3$ он станет красным.
Ответ: 1
В) Na₂SO₄ и LiNO₃
Решение
Здесь необходимо различить две соли: сульфат натрия ($Na_2SO_4$) и нитрат лития ($LiNO_3$). Обе соли образованы сильными кислотами и сильными основаниями, поэтому их водные растворы нейтральны, и индикатор не поможет. Следует искать качественную реакцию на один из ионов ($Na^+$, $SO_4^{2-}$, $Li^+$, $NO_3^-$). Качественным реактивом на сульфат-ион ($SO_4^{2-}$) являются растворимые соли бария, в данном случае — хлорид бария ($BaCl_2$).
При добавлении $BaCl_2$ к раствору $Na_2SO_4$ выпадет белый осадок сульфата бария:
$Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
В то же время, нитрат лития с хлоридом бария не реагирует с образованием осадка, так как все возможные продукты растворимы в воде. Таким образом, по наличию осадка можно определить, в какой пробирке находится сульфат натрия.
Ответ: 3
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 12 расположенного на странице 169 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №12 (с. 169), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.














