Номер 12, страница 179 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Контрольные работы. Металлы. Вариант 4 - номер 12, страница 179.
№12 (с. 179)
Условие. №12 (с. 179)
скриншот условия

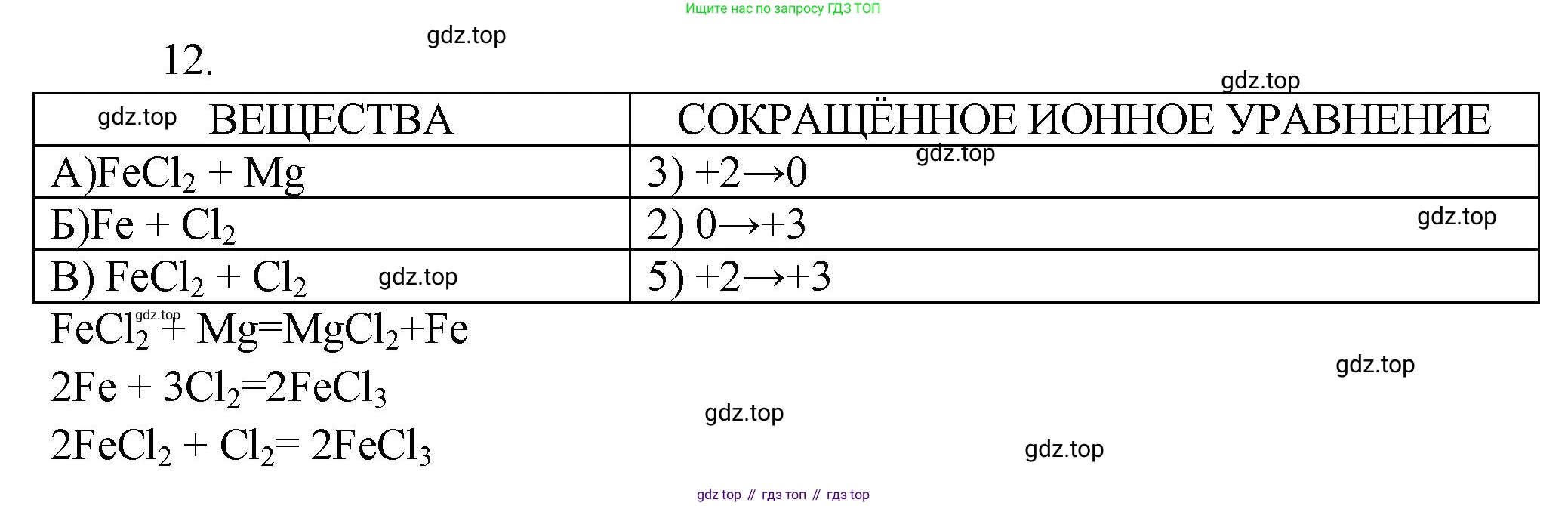
12. Установите соответствие между реагентами и изменением степени окисления железа в результате реакции между ними.
РЕАГЕНТЫ
А) $\text{FeCl}_2 + \text{Mg} \to$
Б) $\text{Fe} + \text{Cl}_2 \to$
В) $\text{FeCl}_2 + \text{Cl}_2 \to$
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ЖЕЛЕЗА
1) $0 \to +2$
2) $0 \to +3$
3) $+2 \to 0$
4) $+3 \to +2$
5) $+2 \to +3$
Решение. №12 (с. 179)
Решение 2. №12 (с. 179)
А) $FeCl_2 + Mg$
В этой реакции нужно установить, как меняется степень окисления железа.
1. Исходная степень окисления железа. В хлориде железа(II) ($FeCl_2$) степень окисления хлора равна -1. Поскольку в формуле два атома хлора, их суммарный отрицательный заряд составляет $2 \times (-1) = -2$. Чтобы молекула была электронейтральной, железо ($Fe$) должно иметь степень окисления +2. Итак, $Fe^{+2}$.
2. Продукты реакции. Магний ($Mg$) стоит в ряду активности металлов левее железа ($Fe$), то есть является более активным металлом. Следовательно, магний вытесняет железо из его соли. Уравнение реакции: $FeCl_2 + Mg \rightarrow MgCl_2 + Fe$
3. Конечная степень окисления железа. В результате реакции образуется чистое железо ($Fe$), которое является простым веществом. Степень окисления любого простого вещества равна 0. Итак, $Fe^{0}$.
4. Изменение степени окисления. Степень окисления железа изменилась с +2 до 0.
Этот переход соответствует варианту 3.
Ответ: 3
Б) $Fe + Cl_2 \rightarrow$
Рассмотрим изменение степени окисления железа в этой реакции.
1. Исходная степень окисления железа. Железо ($Fe$) в левой части уравнения представлено как простое вещество, поэтому его степень окисления равна 0. Итак, $Fe^{0}$.
2. Продукты реакции. Хлор ($Cl_2$) — это сильный окислитель. При реакции с сильными окислителями, такими как галогены, железо окисляется до своей наиболее устойчивой высшей степени окисления, равной +3. Реакция протекает по следующей схеме: $2Fe + 3Cl_2 \rightarrow 2FeCl_3$
3. Конечная степень окисления железа. В продукте реакции, хлориде железа(III) ($FeCl_3$), степень окисления хлора -1. Три атома хлора создают заряд -3, следовательно, железо ($Fe$) имеет степень окисления +3. Итак, $Fe^{+3}$.
4. Изменение степени окисления. Степень окисления железа изменилась с 0 до +3.
Этот переход соответствует варианту 2.
Ответ: 2
В) $FeCl_2 + Cl_2$
Определим изменение степени окисления железа для этого процесса.
1. Исходная степень окисления железа. В исходном веществе, хлориде железа(II) ($FeCl_2$), степень окисления железа равна +2, как было установлено в пункте А. Итак, $Fe^{+2}$.
2. Продукты реакции. Хлор ($Cl_2$), будучи сильным окислителем, вступает в реакцию с хлоридом железа(II), доокисляя железо до степени окисления +3. $2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$
3. Конечная степень окисления железа. В конечном продукте, хлориде железа(III) ($FeCl_3$), степень окисления железа равна +3, как было показано в пункте Б. Итак, $Fe^{+3}$.
4. Изменение степени окисления. Степень окисления железа изменилась с +2 до +3.
Этот переход соответствует варианту 5.
Ответ: 5
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 12 расположенного на странице 179 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №12 (с. 179), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















