Номер 1, страница 48 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §11. Общая характеристика элементов VIIA - группы - галогенов. Часть 2 - номер 1, страница 48.
№1 (с. 48)
Условие. №1 (с. 48)
скриншот условия

Часть II
1. Запишите несколько уравнений реакций, с помощью которых можно получить хлорид железа(III). Реакции с участием электролитов запишите в ионной форме, в окислительно-восстановительных реакциях расставьте коэффициенты с помощью метода электронного баланса.
Решение. №1 (с. 48)

Решение 2. №1 (с. 48)
Решение
Хлорид железа(III) ($FeCl_3$) можно получить несколькими способами. Рассмотрим три из них, включая реакции ионного обмена и окислительно-восстановительные реакции.
1. Прямой синтез: взаимодействие железа с хлором
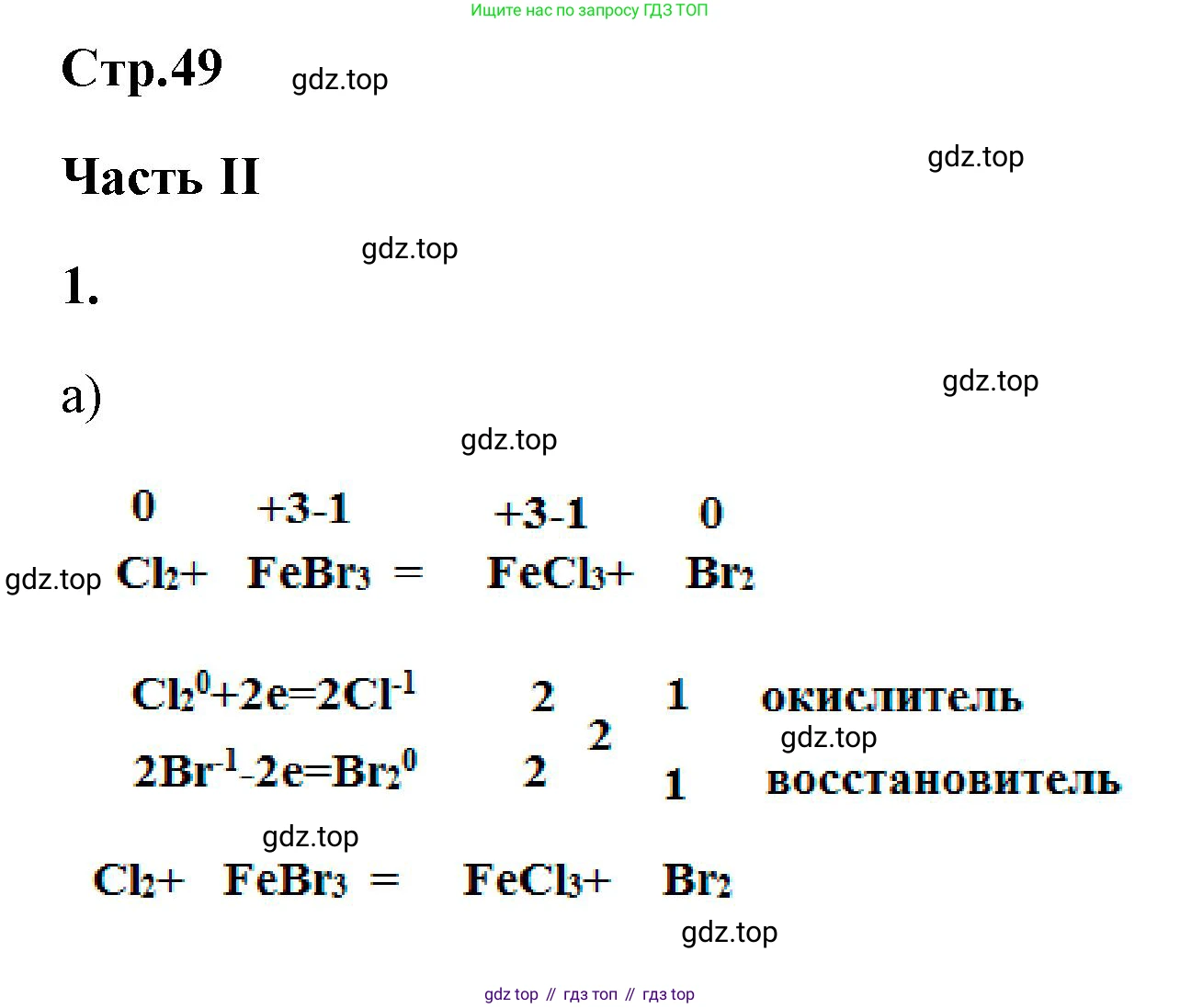
Это окислительно-восстановительная реакция. Железо окисляется, а хлор восстанавливается.
Молекулярное уравнение реакции:
$2Fe + 3Cl_2 \rightarrow 2FeCl_3$
Составим электронный баланс для расстановки коэффициентов:
$Fe^0 - 3e^- \rightarrow Fe^{+3}$ | 2 (процесс окисления, $Fe$ - восстановитель)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 3 (процесс восстановления, $Cl_2$ - окислитель)
Эта реакция протекает между твердым веществом и газом, без участия электролитов в качестве исходных веществ, поэтому ионная форма для нее не записывается.
Ответ: $2Fe + 3Cl_2 \xrightarrow{t} 2FeCl_3$.
2. Взаимодействие оксида железа(III) с соляной кислотой
Это реакция ионного обмена между основным оксидом и кислотой. Так как в реакции участвуют электролиты (соляная кислота и образующаяся соль), запишем ее в ионной форме.
Молекулярное уравнение реакции:
$Fe_2O_3 + 6HCl \rightarrow 2FeCl_3 + 3H_2O$
Полное ионное уравнение (учитывая, что $Fe_2O_3$ - нерастворимый оксид, $HCl$ - сильная кислота, $FeCl_3$ - растворимая соль, $H_2O$ - слабый электролит):
$Fe_2O_3(тв) + 6H^+ + 6Cl^- \rightarrow 2Fe^{3+} + 6Cl^- + 3H_2O$
Сокращенное ионное уравнение (исключаем ионы-наблюдатели $Cl^-$):
$Fe_2O_3(тв) + 6H^+ \rightarrow 2Fe^{3+} + 3H_2O$
Ответ: Молекулярное уравнение: $Fe_2O_3 + 6HCl \rightarrow 2FeCl_3 + 3H_2O$; Сокращенное ионное уравнение: $Fe_2O_3 + 6H^+ \rightarrow 2Fe^{3+} + 3H_2O$.
3. Окисление хлорида железа(II) хлором
Это окислительно-восстановительная реакция, в которой железо в степени окисления +2 окисляется до +3 более сильным окислителем - хлором.
Молекулярное уравнение реакции:
$2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$
Составим электронный баланс:
$Fe^{+2} - 1e^- \rightarrow Fe^{+3}$ | 2 (процесс окисления, $Fe^{+2}$ - восстановитель)
$Cl_2^0 + 2e^- \rightarrow 2Cl^{-1}$ | 1 (процесс восстановления, $Cl_2$ - окислитель)
Так как исходная и конечная соли железа являются растворимыми электролитами, запишем ионные уравнения.
Полное ионное уравнение:
$2Fe^{2+} + 4Cl^- + Cl_2 \rightarrow 2Fe^{3+} + 6Cl^-$
Сокращенное ионное уравнение (исключаем 4 иона $Cl^-$ с каждой стороны):
$2Fe^{2+} + Cl_2 \rightarrow 2Fe^{3+} + 2Cl^-$
Ответ: Молекулярное уравнение: $2FeCl_2 + Cl_2 \rightarrow 2FeCl_3$; Сокращенное ионное уравнение: $2Fe^{2+} + Cl_2 \rightarrow 2Fe^{3+} + 2Cl^-$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 48 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 48), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















