Номер 9, страница 131 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 2. Общие свойства металлов. Параграф 27. Сплавы - номер 9, страница 131.
№9 (с. 131)
Условие. №9 (с. 131)
скриншот условия

9. При восстановлении 2,66 г высшего оксида ниобия до низшего было израсходовано 0,672 л водорода (н. у.). Определите формулу низшего оксида.
Решение. №9 (с. 131)

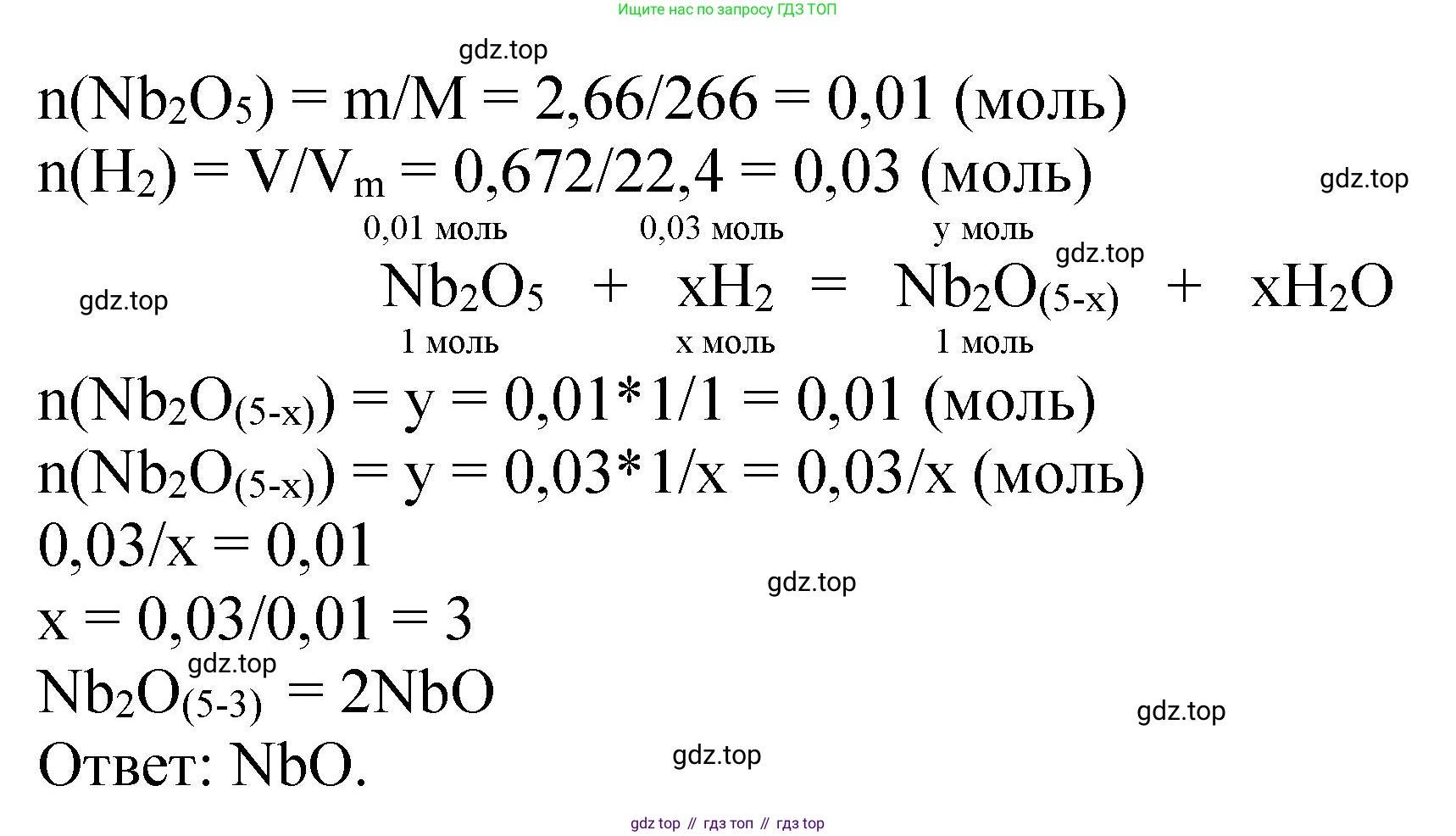
Решение 2. №9 (с. 131)
Дано:
$m(Nb_xO_y)_{\text{высш}} = 2,66 \text{ г}$
$V(H_2) = 0,672 \text{ л}$ (н. у.)
Найти:
Формулу низшего оксида ниобия.
Решение:
1. Определим формулу высшего оксида ниобия. Ниобий (Nb) является элементом V группы периодической системы, следовательно, его высшая степень окисления равна +5. Степень окисления кислорода в оксидах равна -2. Для составления формулы оксида необходимо, чтобы суммарный заряд был равен нулю. Наименьшее общее кратное для 5 и 2 равно 10. Таким образом, на 2 атома ниобия приходится 5 атомов кислорода. Формула высшего оксида ниобия – $Nb_2O_5$.
2. Рассчитаем молярную массу высшего оксида ниобия $Nb_2O_5$. Используем относительные атомные массы элементов из периодической таблицы: $Ar(Nb) \approx 93$, $Ar(O) \approx 16$.
$M(Nb_2O_5) = 2 \cdot Ar(Nb) + 5 \cdot Ar(O) = 2 \cdot 93 + 5 \cdot 16 = 186 + 80 = 266 \text{ г/моль}$
3. Найдем количество вещества (в молях) высшего оксида ниобия, которое вступило в реакцию.
$n(Nb_2O_5) = \frac{m(Nb_2O_5)}{M(Nb_2O_5)} = \frac{2,66 \text{ г}}{266 \text{ г/моль}} = 0,01 \text{ моль}$
4. Найдем количество вещества водорода, которое было израсходовано. Объем газа дан при нормальных условиях (н. у.), поэтому для расчета используем молярный объем газа $V_m = 22,4 \text{ л/моль}$.
$n(H_2) = \frac{V(H_2)}{V_m} = \frac{0,672 \text{ л}}{22,4 \text{ л/моль}} = 0,03 \text{ моль}$
5. В реакции восстановления оксида водородом, водород соединяется с кислородом из оксида, образуя воду. Уравнение этого процесса: $O + H_2 \rightarrow H_2O$. Из этого следует, что количество моль атомов кислорода, удаленных из оксида, равно количеству моль молекул водорода, вступивших в реакцию.
$n(O)_{\text{удал.}} = n(H_2) = 0,03 \text{ моль}$
6. Теперь определим, сколько ниобия и кислорода было в исходном веществе и сколько осталось в конечном продукте.
В $0,01 \text{ моль}$ $Nb_2O_5$ содержится:
$n(Nb) = 2 \cdot n(Nb_2O_5) = 2 \cdot 0,01 \text{ моль} = 0,02 \text{ моль}$
$n(O)_{\text{исх.}} = 5 \cdot n(Nb_2O_5) = 5 \cdot 0,01 \text{ моль} = 0,05 \text{ моль}$
Ниобий в ходе реакции не расходуется, поэтому его количество в низшем оксиде остается тем же: $n(Nb) = 0,02 \text{ моль}$.
Количество кислорода в низшем оксиде будет равно разности исходного количества и удаленного:
$n(O)_{\text{кон.}} = n(O)_{\text{исх.}} - n(O)_{\text{удал.}} = 0,05 \text{ моль} - 0,03 \text{ моль} = 0,02 \text{ моль}$
7. Зная мольные количества ниобия и кислорода в низшем оксиде, найдем их соотношение, чтобы определить формулу.
Соотношение $n(Nb) : n(O)_{\text{кон.}} = 0,02 : 0,02 = 1 : 1$.
Следовательно, простейшая (эмпирическая) формула низшего оксида ниобия – $NbO$.
Ответ: $NbO$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 9 расположенного на странице 131 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 131), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















