Номер 3, страница 139 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 3. Металлы главных подгрупп. Параграф 29. Натрий и калий - номер 3, страница 139.
№3 (с. 139)
Условие. №3 (с. 139)
скриншот условия

3. Какой из минералов — чилийская селитра $NaNO_3$, галит $NaCl$, мирабилит $Na_2SO_4 \cdot 10H_2O$, криолит $Na_3AlF_6$ — наиболее богат натрием?
Решение. №3 (с. 139)
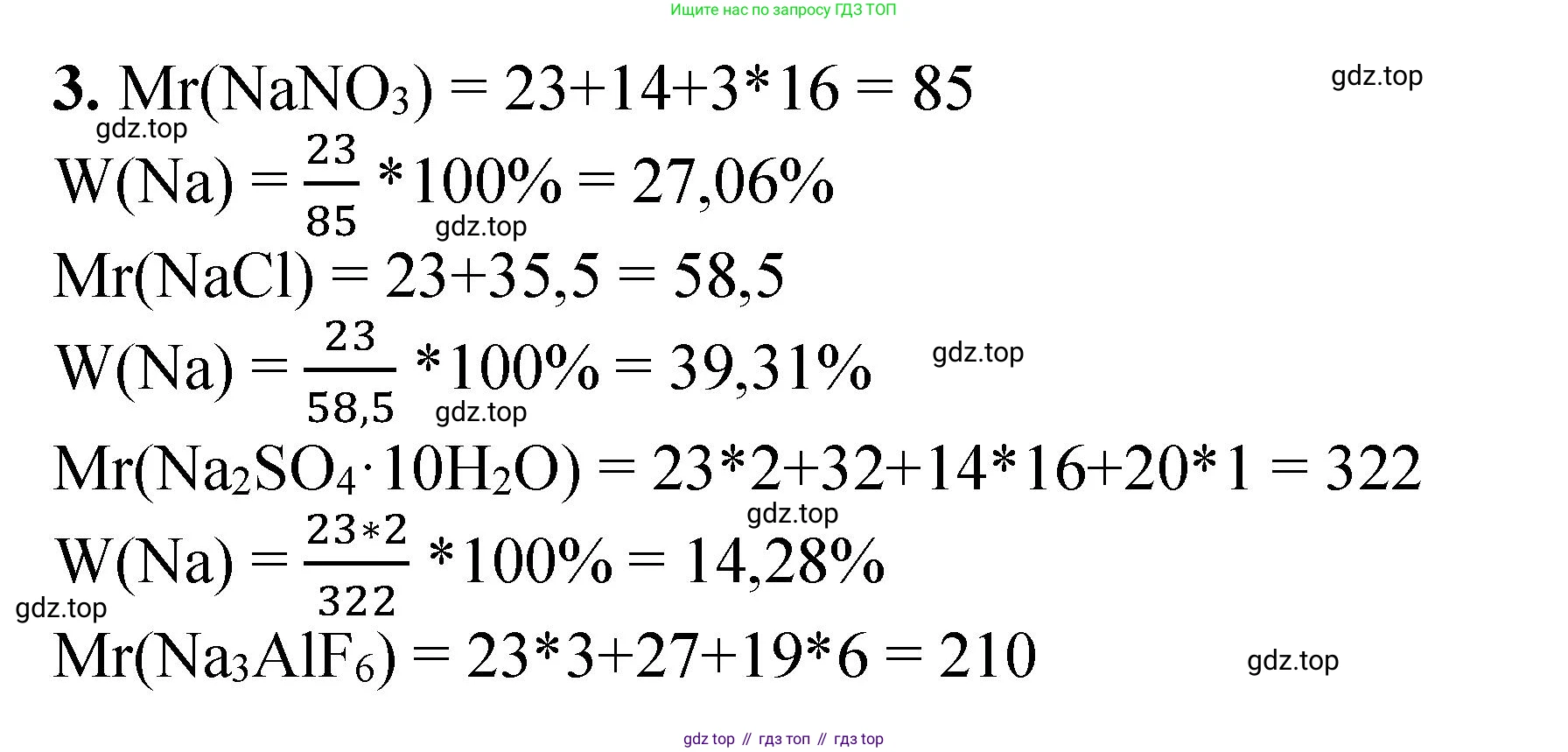

Решение 2. №3 (с. 139)
Дано:
Минералы:
чилийская селитра (NaNO₃)
галит (NaCl)
мирабилит (Na₂SO₄·10H₂O)
криолит (Na₃AlF₆)
Найти:
Минерал с наибольшей массовой долей натрия ($ \omega(Na) $).
Решение:
Чтобы определить, какой из минералов наиболее богат натрием, необходимо рассчитать массовую долю натрия ($ \omega(Na) $) в каждом из соединений. Массовая доля элемента в веществе вычисляется по формуле:
$ \omega(Э) = \frac{n \cdot A_r(Э)}{M_r(вещества)} \cdot 100\% $
где $ n $ — количество атомов этого элемента в формуле вещества, $ A_r(Э) $ — относительная атомная масса элемента, $ M_r(вещества) $ — относительная молекулярная масса вещества.
Для расчетов используем округленные значения относительных атомных масс:
- $ A_r(Na) = 23 $
- $ A_r(N) = 14 $
- $ A_r(O) = 16 $
- $ A_r(Cl) = 35.5 $
- $ A_r(S) = 32 $
- $ A_r(H) = 1 $
- $ A_r(Al) = 27 $
- $ A_r(F) = 19 $
Рассчитаем массовую долю натрия для каждого минерала.
Чилийская селитра NaNO₃
1. Относительная молекулярная масса:
$ M_r(NaNO_3) = A_r(Na) + A_r(N) + 3 \cdot A_r(O) = 23 + 14 + 3 \cdot 16 = 85 $
2. Массовая доля натрия:
$ \omega(Na) = \frac{1 \cdot A_r(Na)}{M_r(NaNO_3)} \cdot 100\% = \frac{23}{85} \cdot 100\% \approx 27,06\% $
Галит NaCl
1. Относительная молекулярная масса:
$ M_r(NaCl) = A_r(Na) + A_r(Cl) = 23 + 35,5 = 58,5 $
2. Массовая доля натрия:
$ \omega(Na) = \frac{1 \cdot A_r(Na)}{M_r(NaCl)} \cdot 100\% = \frac{23}{58,5} \cdot 100\% \approx 39,32\% $
Мирабилит Na₂SO₄·10H₂O
1. Относительная молекулярная масса:
$ M_r(Na_2SO_4 \cdot 10H_2O) = 2 \cdot A_r(Na) + A_r(S) + 4 \cdot A_r(O) + 10 \cdot (2 \cdot A_r(H) + A_r(O)) $
$ M_r(Na_2SO_4 \cdot 10H_2O) = 2 \cdot 23 + 32 + 4 \cdot 16 + 10 \cdot (2 \cdot 1 + 16) = 46 + 32 + 64 + 180 = 322 $
2. Массовая доля натрия:
$ \omega(Na) = \frac{2 \cdot A_r(Na)}{M_r(Na_2SO_4 \cdot 10H_2O)} \cdot 100\% = \frac{2 \cdot 23}{322} \cdot 100\% = \frac{46}{322} \cdot 100\% \approx 14,29\% $
Криолит Na₃AlF₆
1. Относительная молекулярная масса:
$ M_r(Na_3AlF_6) = 3 \cdot A_r(Na) + A_r(Al) + 6 \cdot A_r(F) = 3 \cdot 23 + 27 + 6 \cdot 19 = 69 + 27 + 114 = 210 $
2. Массовая доля натрия:
$ \omega(Na) = \frac{3 \cdot A_r(Na)}{M_r(Na_3AlF_6)} \cdot 100\% = \frac{3 \cdot 23}{210} \cdot 100\% = \frac{69}{210} \cdot 100\% \approx 32,86\% $
Сравним полученные результаты:
- $ \omega(Na) $ в NaNO₃ ≈ 27,06%
- $ \omega(Na) $ в NaCl ≈ 39,32%
- $ \omega(Na) $ в Na₂SO₄·10H₂O ≈ 14,29%
- $ \omega(Na) $ в Na₃AlF₆ ≈ 32,86%
Сравнивая массовые доли $ 39,32\% > 32,86\% > 27,06\% > 14,29\% $, делаем вывод, что наибольшее содержание натрия в галите.
Ответ: наиболее богат натрием галит (NaCl), так как массовая доля натрия в нем составляет 39,32%, что выше, чем в других представленных минералах.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 3 расположенного на странице 139 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 139), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















