Номер 11, страница 144 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 3. Металлы главных подгрупп. Параграф 30. Соединения натрия и калия - номер 11, страница 144.
№11 (с. 144)
Условие. №11 (с. 144)
скриншот условия
11. Сколько граммов кристаллогидрата $\text{Na}_2\text{SO}_4 \cdot 10\text{H}_2\text{O}$ необходимо добавить к 100 мл 8%-го раствора сульфата натрия плотностью 1,07 г/мл, чтобы получить 16%-й раствор?
Решение. №11 (с. 144)

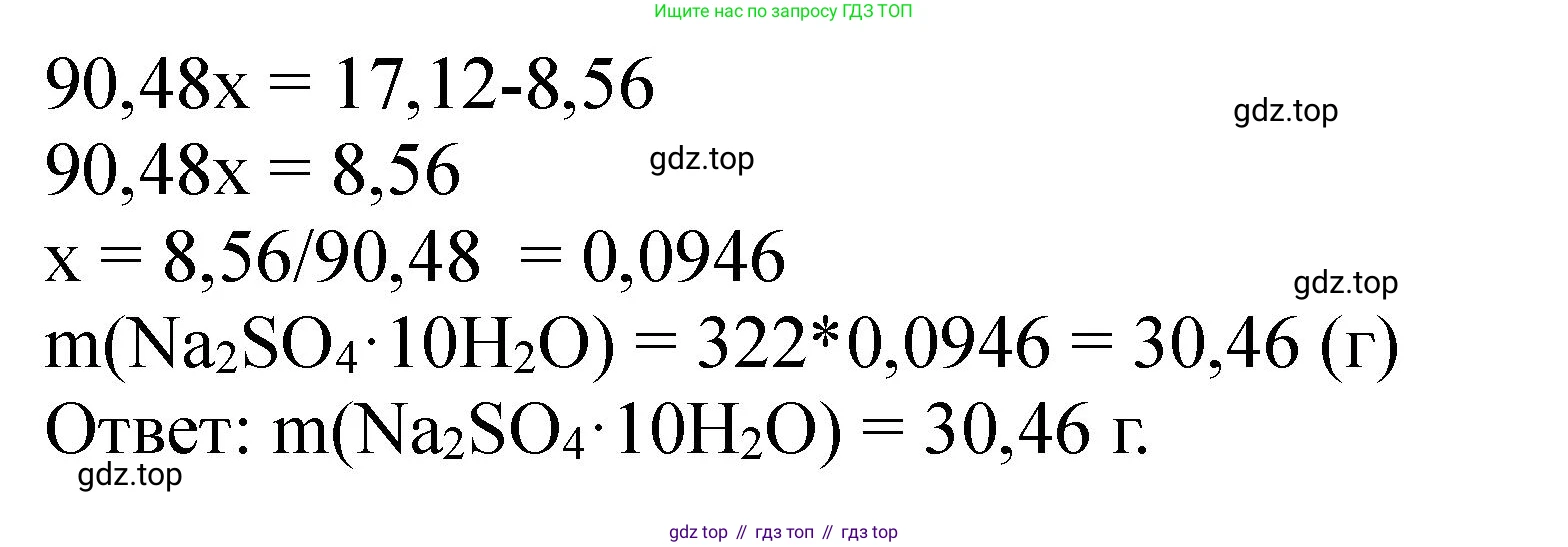
Решение 2. №11 (с. 144)
Дано:
$V_{р-ра1}(Na_2SO_4) = 100$ мл
$w_{1}(Na_2SO_4) = 8\% = 0.08$
$\rho_{1} = 1.07$ г/мл
$w_{2}(Na_2SO_4) = 16\% = 0.16$
Найти:
$m(Na_2SO_4 \cdot 10H_2O) - ?$
Решение:
1. Найдем массу исходного 8%-го раствора сульфата натрия по формуле $m = \rho \cdot V$:
$m_{р-ра1} = 1.07 \text{ г/мл} \cdot 100 \text{ мл} = 107 \text{ г}$
2. Рассчитаем массу безводного сульфата натрия ($Na_2SO_4$) в исходном растворе:
$m_{соли1}(Na_2SO_4) = m_{р-ра1} \cdot w_1 = 107 \text{ г} \cdot 0.08 = 8.56 \text{ г}$
3. Обозначим массу кристаллогидрата $Na_2SO_4 \cdot 10H_2O$, которую необходимо добавить, через $x$ грамм.
4. Найдем молярные массы безводной соли и кристаллогидрата. Используем относительные атомные массы: $Ar(Na)=23$, $Ar(S)=32$, $Ar(O)=16$, $Ar(H)=1$.
$M(Na_2SO_4) = 2 \cdot 23 + 32 + 4 \cdot 16 = 46 + 32 + 64 = 142$ г/моль
$M(H_2O) = 2 \cdot 1 + 16 = 18$ г/моль
$M(Na_2SO_4 \cdot 10H_2O) = M(Na_2SO_4) + 10 \cdot M(H_2O) = 142 + 10 \cdot 18 = 142 + 180 = 322$ г/моль
5. Рассчитаем массовую долю безводного сульфата натрия в кристаллогидрате:
$w(Na_2SO_4 \text{ в крист.}) = \frac{M(Na_2SO_4)}{M(Na_2SO_4 \cdot 10H_2O)} = \frac{142}{322}$
Масса чистого $Na_2SO_4$, которая вносится вместе с $x$ граммами кристаллогидрата, равна:
$m_{соли\_добав} = x \cdot \frac{142}{322}$ г
6. Составим уравнение для массовой доли вещества в конечном растворе. Масса конечного раствора ($m_{р-ра2}$) будет равна сумме массы исходного раствора и всей массы добавленного кристаллогидрата. Масса соли в конечном растворе ($m_{соли2}$) будет равна сумме массы соли в исходном растворе и массы соли из добавленного кристаллогидрата.
$m_{р-ра2} = m_{р-ра1} + x = 107 + x$
$m_{соли2} = m_{соли1} + m_{соли\_добав} = 8.56 + x \cdot \frac{142}{322}$
Формула массовой доли для конечного раствора:
$w_2 = \frac{m_{соли2}}{m_{р-ра2}}$
Подставим известные значения и решим уравнение относительно $x$:
$0.16 = \frac{8.56 + x \cdot \frac{142}{322}}{107 + x}$
$0.16 \cdot (107 + x) = 8.56 + \frac{142}{322}x$
$17.12 + 0.16x = 8.56 + \frac{142}{322}x$
Перенесем слагаемые с $x$ в одну сторону, а числовые значения — в другую:
$\frac{142}{322}x - 0.16x = 17.12 - 8.56$
$(\frac{142}{322} - 0.16)x = 8.56$
Для удобства вычислений $\frac{142}{322} \approx 0.441$
$(0.441 - 0.16)x = 8.56$
$0.281x = 8.56$
$x = \frac{8.56}{0.281} \approx 30.46$ г
Ответ: необходимо добавить 30,46 г кристаллогидрата $Na_2SO_4 \cdot 10H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 11 расположенного на странице 144 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №11 (с. 144), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















