Номер 4, страница 199 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 41. Марганец - номер 4, страница 199.
№4 (с. 199)
Условие. №4 (с. 199)
скриншот условия

4. Закончите уравнения окислительно-восстановительных реакций с участием перманганата калия:
а) $KMnO_4 + Na_2S + H_2SO_4 \rightarrow S + ...;$
б) $KMnO_4 + KOH \xrightarrow{t} O_2 + ...;$
в) $KMnO_4 + NaBr + H_2SO_4 \rightarrow Br_2 + ...;$
г) $KMnO_4 + KI + H_2O \rightarrow I_2 + ...;$
д) пропен $+ KMnO_4 + H_2O \xrightarrow{0^{\circ}C} ...;$
е) бутен-2 $+ KMnO_4 + H_2SO_4 \xrightarrow{t} ...;$
ж) стирол $+ KMnO_4 + H_2SO_4 \xrightarrow{t} ....$
Помните, что восстановление перманганата калия в зависимости от кислотности среды приводит к различным продуктам.
Решение. №4 (с. 199)

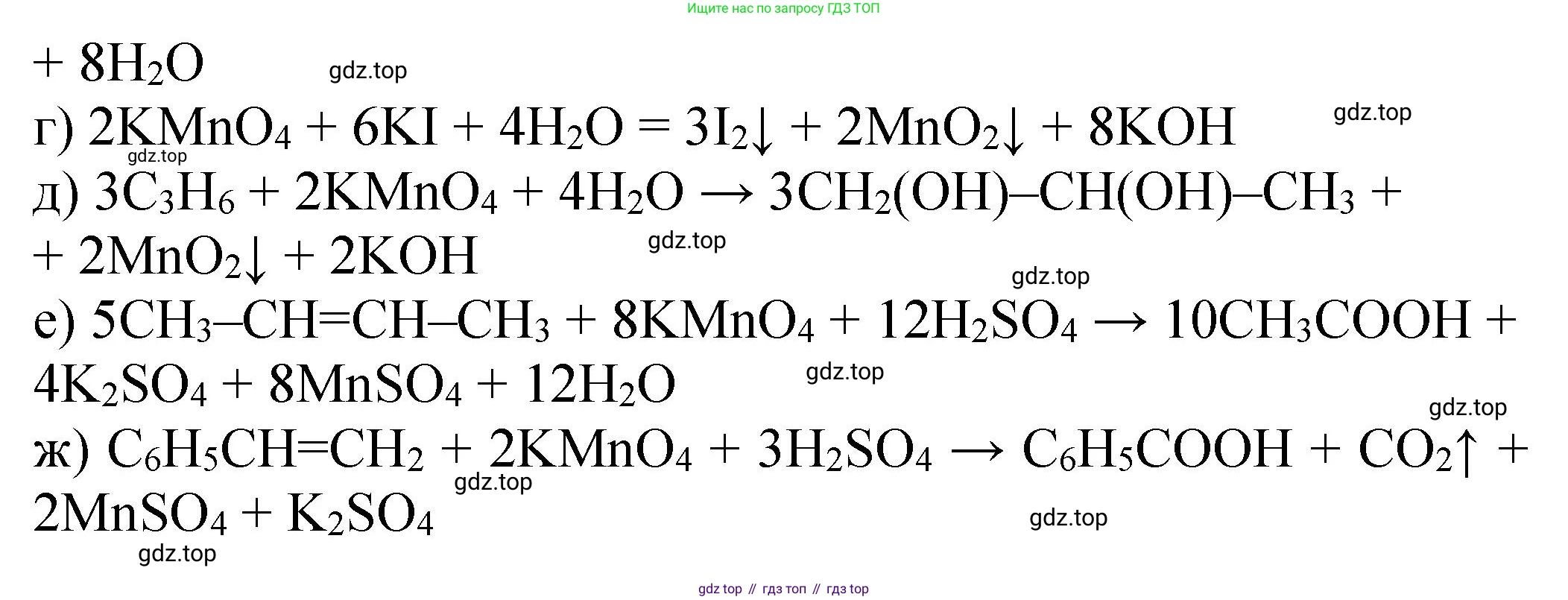
Решение 2. №4 (с. 199)
а) Решение:
В данной реакции перманганат калия ($KMnO_4$) выступает в роли окислителя в кислой среде (серная кислота $H_2SO_4$), а сульфид натрия ($Na_2S$) – в роли восстановителя. В кислой среде марганец восстанавливается со степени окисления $+7$ до $+2$. Сера в сульфиде окисляется со степени окисления $-2$ до $0$ (свободная сера). Составим электронный баланс:
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 2 (окислитель)
$S^{-2} - 2e^- \rightarrow S^0$ | 5 (восстановитель)
Из баланса видно, что на 2 моль $KMnO_4$ требуется 5 моль $Na_2S$. Продуктами реакции будут сульфат марганца(II) ($MnSO_4$), сера ($S$), сульфат калия ($K_2SO_4$), сульфат натрия ($Na_2SO_4$) и вода ($H_2O$). Расставим коэффициенты в уравнении реакции:
$2KMnO_4 + 5Na_2S + 8H_2SO_4 \rightarrow 2MnSO_4 + 5S \downarrow + K_2SO_4 + 5Na_2SO_4 + 8H_2O$
Ответ: $2KMnO_4 + 5Na_2S + 8H_2SO_4 \rightarrow 2MnSO_4 + 5S \downarrow + K_2SO_4 + 5Na_2SO_4 + 8H_2O$
б) Решение:
Данная реакция представляет собой диспропорционирование при нагревании перманганата калия в концентрированном растворе щелочи. В этой реакции часть атомов марганца восстанавливается, а кислород из гидроксид-ионов окисляется. Марганец восстанавливается со степени окисления $+7$ до $+6$, образуя манганат калия ($K_2MnO_4$), а кислород окисляется со степени окисления $-2$ до $0$, образуя молекулярный кислород ($O_2$). Составим электронный баланс:
$Mn^{+7} + 1e^- \rightarrow Mn^{+6}$ | 4 (окислитель)
$2O^{-2} - 4e^- \rightarrow O_2^0$ | 1 (восстановитель)
Продуктами реакции являются манганат калия, кислород и вода. Расставим коэффициенты в уравнении реакции:
$4KMnO_4 + 4KOH \xrightarrow{t} 4K_2MnO_4 + O_2 \uparrow + 2H_2O$
Ответ: $4KMnO_4 + 4KOH \xrightarrow{t} 4K_2MnO_4 + O_2 \uparrow + 2H_2O$
в) Решение:
Это окислительно-восстановительная реакция в кислой среде ($H_2SO_4$). Окислитель – $KMnO_4$, восстановитель – бромид натрия ($NaBr$). Марганец восстанавливается с $+7$ до $+2$. Бромид-ион окисляется с $-1$ до $0$ (свободный бром $Br_2$). Составим электронный баланс:
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 2 (окислитель)
$2Br^- - 2e^- \rightarrow Br_2^0$ | 5 (восстановитель)
На 2 моль $KMnO_4$ требуется 10 моль $NaBr$. Продуктами реакции будут сульфат марганца(II) ($MnSO_4$), бром ($Br_2$), сульфат калия ($K_2SO_4$), сульфат натрия ($Na_2SO_4$) и вода ($H_2O$). Расставим коэффициенты:
$2KMnO_4 + 10NaBr + 8H_2SO_4 \rightarrow 2MnSO_4 + 5Br_2 + K_2SO_4 + 5Na_2SO_4 + 8H_2O$
Ответ: $2KMnO_4 + 10NaBr + 8H_2SO_4 \rightarrow 2MnSO_4 + 5Br_2 + K_2SO_4 + 5Na_2SO_4 + 8H_2O$
г) Решение:
Реакция протекает в нейтральной среде ($H_2O$). Окислитель – $KMnO_4$, восстановитель – иодид калия ($KI$). В нейтральной среде марганец восстанавливается с $+7$ до $+4$, образуя диоксид марганца ($MnO_2$). Иодид-ион окисляется с $-1$ до $0$ (свободный иод $I_2$). Составим электронный баланс:
$Mn^{+7} + 3e^- \rightarrow Mn^{+4}$ | 2 (окислитель)
$2I^- - 2e^- \rightarrow I_2^0$ | 3 (восстановитель)
На 2 моль $KMnO_4$ требуется 6 моль $KI$. Продуктами реакции являются диоксид марганца, иод и гидроксид калия ($KOH$), который образуется в результате восстановления перманганата в водной среде. Расставим коэффициенты:
$2KMnO_4 + 6KI + 4H_2O \rightarrow 2MnO_2 \downarrow + 3I_2 + 8KOH$
Ответ: $2KMnO_4 + 6KI + 4H_2O \rightarrow 2MnO_2 \downarrow + 3I_2 + 8KOH$
д) Решение:
Это реакция Вагнера – мягкое окисление алкенов холодным водным раствором перманганата калия. Пропен ($C_3H_6$) окисляется, а перманганат калия восстанавливается. Двойная связь в пропене разрывается (сигма-связь остается), и по месту разрыва присоединяются две гидроксильные группы, образуя диол (гликоль) – пропан-1,2-диол. Марганец в нейтральной среде при низкой температуре восстанавливается с $+7$ до $+4$ (диоксид марганца $MnO_2$). Составим электронный баланс:
$Mn^{+7} + 3e^- \rightarrow Mn^{+4}$ | 2 (окислитель)
$C_3H_6 - 2e^- \rightarrow C_3H_6(OH)_2$ | 3 (восстановитель)
Продуктами реакции являются пропан-1,2-диол, диоксид марганца и гидроксид калия. Расставим коэффициенты в уравнении:
$3CH_3-CH=CH_2 + 2KMnO_4 + 4H_2O \xrightarrow{0^\circ C} 3CH_3-CH(OH)-CH_2(OH) + 2MnO_2 \downarrow + 2KOH$
Ответ: $3C_3H_6 + 2KMnO_4 + 4H_2O \xrightarrow{0^\circ C} 3C_3H_8O_2 + 2MnO_2 \downarrow + 2KOH$
е) Решение:
Это реакция жесткого окисления алкена (бутена-2) в кислой среде при нагревании. При жестком окислении происходит разрыв двойной связи $C=C$. Атомы углерода при двойной связи окисляются. Так как каждый из этих атомов связан с одним атомом водорода, они оба окисляются до карбоксильных групп ($-COOH$). Молекула бутена-2 расщепляется на две одинаковые молекулы уксусной (этановой) кислоты ($CH_3COOH$). Марганец в кислой среде восстанавливается с $+7$ до $+2$. Составим электронный баланс:
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 8 (окислитель)
$C_4H_8 - 8e^- \rightarrow 2CH_3COOH$ | 5 (восстановитель)
Продукты: уксусная кислота, сульфат марганца(II), сульфат калия и вода. Расставим коэффициенты:
$5CH_3-CH=CH-CH_3 + 8KMnO_4 + 12H_2SO_4 \xrightarrow{t} 10CH_3COOH + 8MnSO_4 + 4K_2SO_4 + 12H_2O$
Ответ: $5C_4H_8 + 8KMnO_4 + 12H_2SO_4 \xrightarrow{t} 10CH_3COOH + 8MnSO_4 + 4K_2SO_4 + 12H_2O$
ж) Решение:
Это реакция жесткого окисления стирола (винилбензола) в кислой среде при нагревании. Бензольное кольцо в этих условиях устойчиво, окисляется только боковая винильная цепь. Двойная связь разрывается. Атом углерода, связанный с бензольным кольцом ($-CH=$), окисляется до карбоксильной группы, образуя бензойную кислоту ($C_6H_5COOH$). Концевой атом углерода ($=CH_2$) окисляется до углекислого газа ($CO_2$). Марганец в кислой среде восстанавливается с $+7$ до $+2$. Составим электронный баланс:
$Mn^{+7} + 5e^- \rightarrow Mn^{+2}$ | 2 (окислитель)
$C_8H_8 - 10e^- \rightarrow C_6H_5COOH + CO_2$ | 1 (восстановитель)
Продукты: бензойная кислота, углекислый газ, сульфат марганца(II), сульфат калия и вода. Расставим коэффициенты:
$5C_6H_5-CH=CH_2 + 10KMnO_4 + 15H_2SO_4 \xrightarrow{t} 5C_6H_5COOH + 5CO_2 \uparrow + 10MnSO_4 + 5K_2SO_4 + 20H_2O$
Данное уравнение можно сократить, разделив все коэффициенты на 5.
Ответ: $C_6H_5CH=CH_2 + 2KMnO_4 + 3H_2SO_4 \xrightarrow{t} C_6H_5COOH + CO_2 \uparrow + 2MnSO_4 + K_2SO_4 + 4H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 199 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 199), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















