Номер 9, страница 199 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 41. Марганец - номер 9, страница 199.
№9 (с. 199)
Условие. №9 (с. 199)
скриншот условия
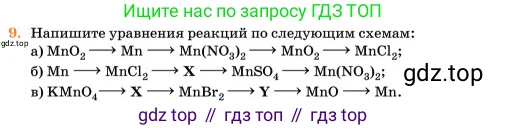
9. Напишите уравнения реакций по следующим схемам:
а) $MnO_2 \rightarrow Mn \rightarrow Mn(NO_3)_2 \rightarrow MnO_2 \rightarrow MnCl_2$;
б) $Mn \rightarrow MnCl_2 \rightarrow$ X $\rightarrow$ $MnSO_4 \rightarrow Mn(NO_3)_2$;
в) $KMnO_4 \rightarrow$ X $\rightarrow$ $MnBr_2 \rightarrow$ Y $\rightarrow$ $MnO \rightarrow Mn$.
Решение. №9 (с. 199)
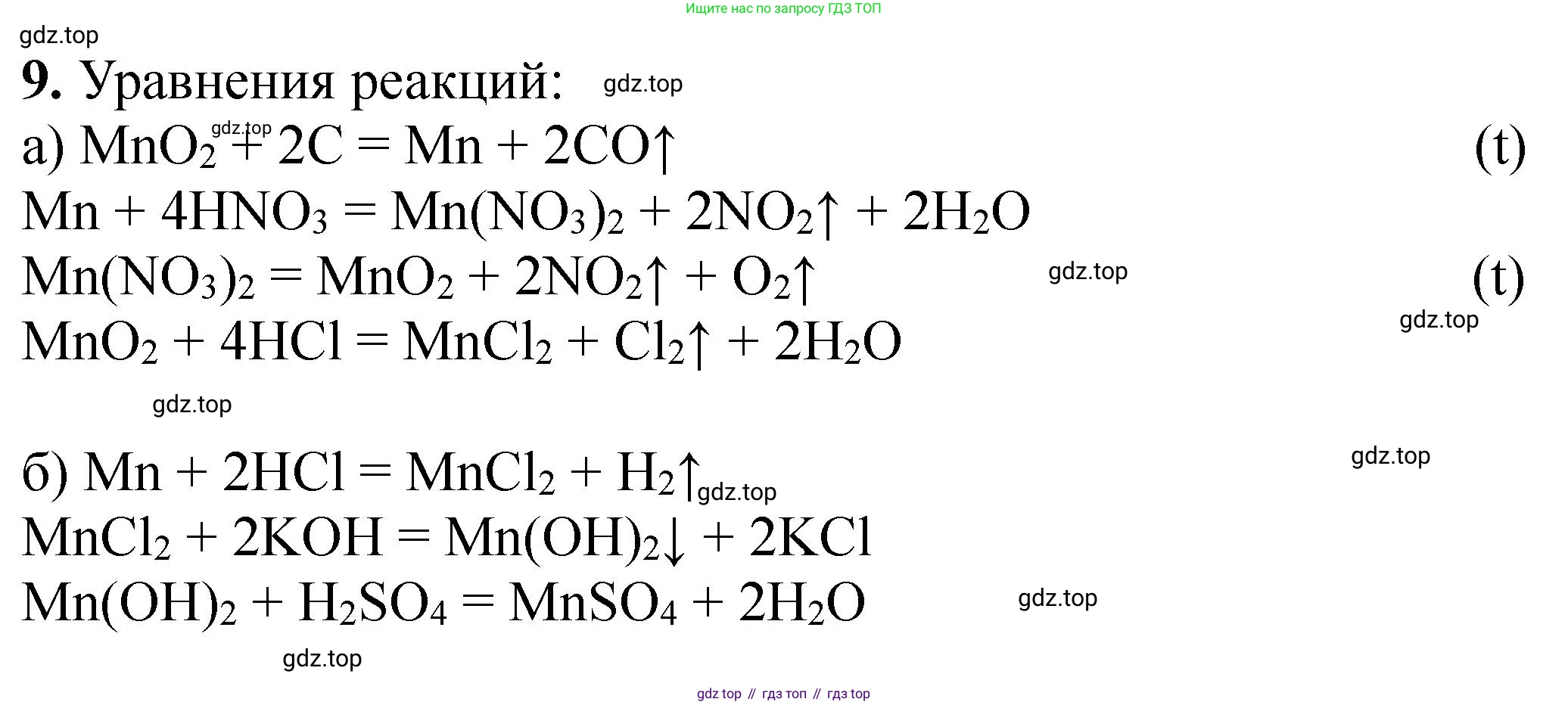
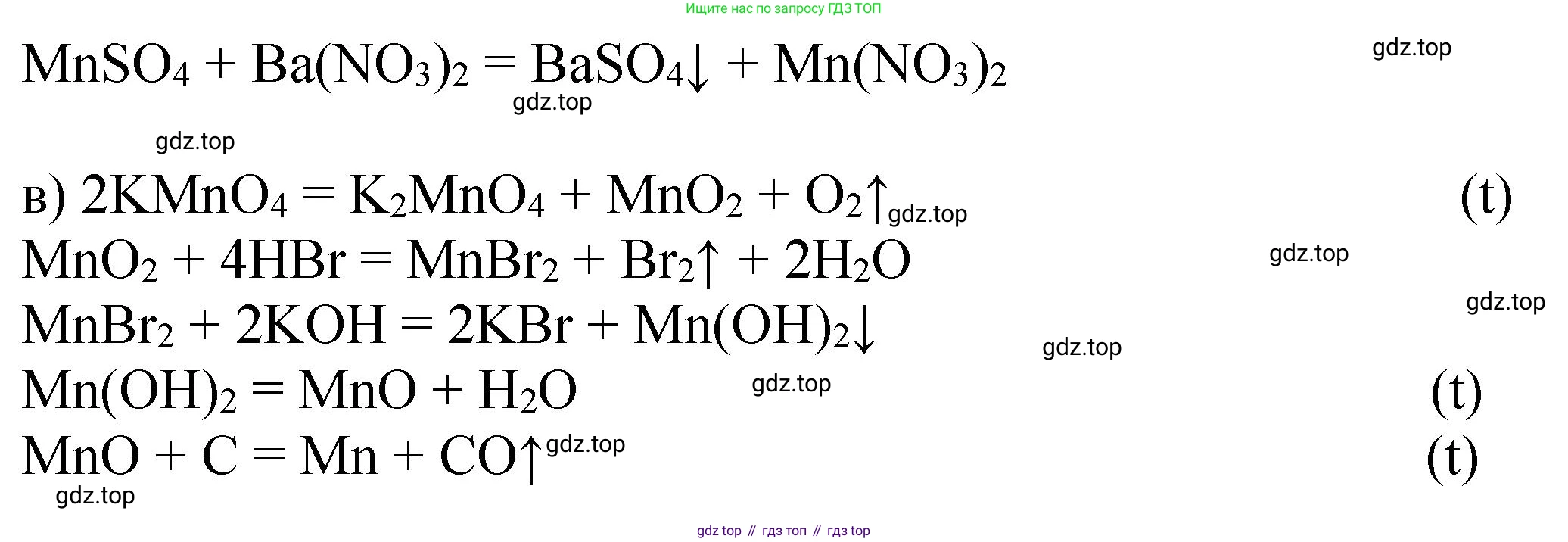
Решение 2. №9 (с. 199)
Решение
а) $MnO_2 \rightarrow Mn \rightarrow Mn(NO_3)_2 \rightarrow MnO_2 \rightarrow MnCl_2$
1. Восстановление оксида марганца(IV) до металлического марганца можно провести с помощью более активного металла, например, алюминия (алюмотермия):
$3MnO_2 + 4Al \xrightarrow{t} 3Mn + 2Al_2O_3$
2. Металлический марганец реагирует с разбавленной азотной кислотой с образованием нитрата марганца(II):
$3Mn + 8HNO_3(\text{разб.}) \rightarrow 3Mn(NO_3)_2 + 2NO \uparrow + 4H_2O$
3. Для получения оксида марганца(IV) из соли марганца(II) необходимо провести окислительно-восстановительную реакцию. Можно использовать реакцию диспропорционирования с перманганатом калия в водной среде:
$3Mn(NO_3)_2 + 2KMnO_4 + 2H_2O \rightarrow 5MnO_2 \downarrow + 2KNO_3 + 4HNO_3$
4. Оксид марганца(IV) реагирует с концентрированной соляной кислотой, проявляя окислительные свойства, с образованием хлорида марганца(II) и выделением хлора:
$MnO_2 + 4HCl(\text{конц.}) \rightarrow MnCl_2 + Cl_2 \uparrow + 2H_2O$
Ответ:
$3MnO_2 + 4Al \xrightarrow{t} 3Mn + 2Al_2O_3$
$3Mn + 8HNO_3(\text{разб.}) \rightarrow 3Mn(NO_3)_2 + 2NO \uparrow + 4H_2O$
$3Mn(NO_3)_2 + 2KMnO_4 + 2H_2O \rightarrow 5MnO_2 \downarrow + 2KNO_3 + 4HNO_3$
$MnO_2 + 4HCl(\text{конц.}) \rightarrow MnCl_2 + Cl_2 \uparrow + 2H_2O$
б) $Mn \rightarrow MnCl_2 \rightarrow X \rightarrow MnSO_4 \rightarrow Mn(NO_3)_2$
1. Марганец, как активный металл, реагирует с соляной кислотой с вытеснением водорода:
$Mn + 2HCl \rightarrow MnCl_2 + H_2 \uparrow$
2. Переход от хлорида к сульфату марганца можно осуществить через промежуточное нерастворимое соединение X. В качестве X можно использовать гидроксид марганца(II), $Mn(OH)_2$. Сначала получаем его по реакции обмена:
$MnCl_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaCl$
3. Затем гидроксид марганца(II) реагирует с серной кислотой, образуя сульфат марганца(II):
$Mn(OH)_2 + H_2SO_4 \rightarrow MnSO_4 + 2H_2O$
4. Для получения нитрата марганца(II) из сульфата можно использовать реакцию ионного обмена с нитратом бария, в результате которой выпадает нерастворимый осадок сульфата бария:
$MnSO_4 + Ba(NO_3)_2 \rightarrow Mn(NO_3)_2 + BaSO_4 \downarrow$
Ответ:
Вещество X – гидроксид марганца(II) - $Mn(OH)_2$.
$Mn + 2HCl \rightarrow MnCl_2 + H_2 \uparrow$
$MnCl_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaCl$
$Mn(OH)_2 + H_2SO_4 \rightarrow MnSO_4 + 2H_2O$
$MnSO_4 + Ba(NO_3)_2 \rightarrow Mn(NO_3)_2 + BaSO_4 \downarrow$
в) $KMnO_4 \rightarrow X \rightarrow MnBr_2 \rightarrow Y \rightarrow MnO \rightarrow Mn$
1. Переход от перманганата калия ($Mn^{+7}$) к соединению марганца в более низкой степени окисления можно провести, восстановив его в нейтральной среде, например, сульфитом натрия. При этом образуется оксид марганца(IV) (X):
$2KMnO_4 + 3Na_2SO_3 + H_2O \rightarrow 2MnO_2 \downarrow + 3Na_2SO_4 + 2KOH$
2. Оксид марганца(IV) реагирует с бромоводородной кислотой, где он выступает в роли окислителя, а бромид-ион — в роли восстановителя:
$MnO_2 + 4HBr \rightarrow MnBr_2 + Br_2 + 2H_2O$
3. Для получения оксида марганца(II) из бромида марганца(II) используем промежуточное соединение Y — гидроксид марганца(II), который получаем по реакции обмена со щелочью:
$MnBr_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaBr$
4. Гидроксид марганца(II) при нагревании без доступа воздуха разлагается до оксида марганца(II):
$Mn(OH)_2 \xrightarrow{t} MnO + H_2O$
5. Восстановление оксида марганца(II) до металлического марганца можно осуществить с помощью угля (карботермия) при высокой температуре:
$MnO + C \xrightarrow{t} Mn + CO \uparrow$
Ответ:
Вещество X – оксид марганца(IV) - $MnO_2$. Вещество Y – гидроксид марганца(II) - $Mn(OH)_2$.
$2KMnO_4 + 3Na_2SO_3 + H_2O \rightarrow 2MnO_2 \downarrow + 3Na_2SO_4 + 2KOH$
$MnO_2 + 4HBr \rightarrow MnBr_2 + Br_2 + 2H_2O$
$MnBr_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaBr$
$Mn(OH)_2 \xrightarrow{t} MnO + H_2O$
$MnO + C \xrightarrow{t} Mn + CO \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 9 расположенного на странице 199 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 199), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















