Номер 3, страница 202 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 42. Железо как химический элемент - номер 3, страница 202.
№3 (с. 202)
Условие. №3 (с. 202)
скриншот условия
3. В одном из оксидов железа массовая доля этого элемента составляет 70%. Определите его формулу.
Решение. №3 (с. 202)
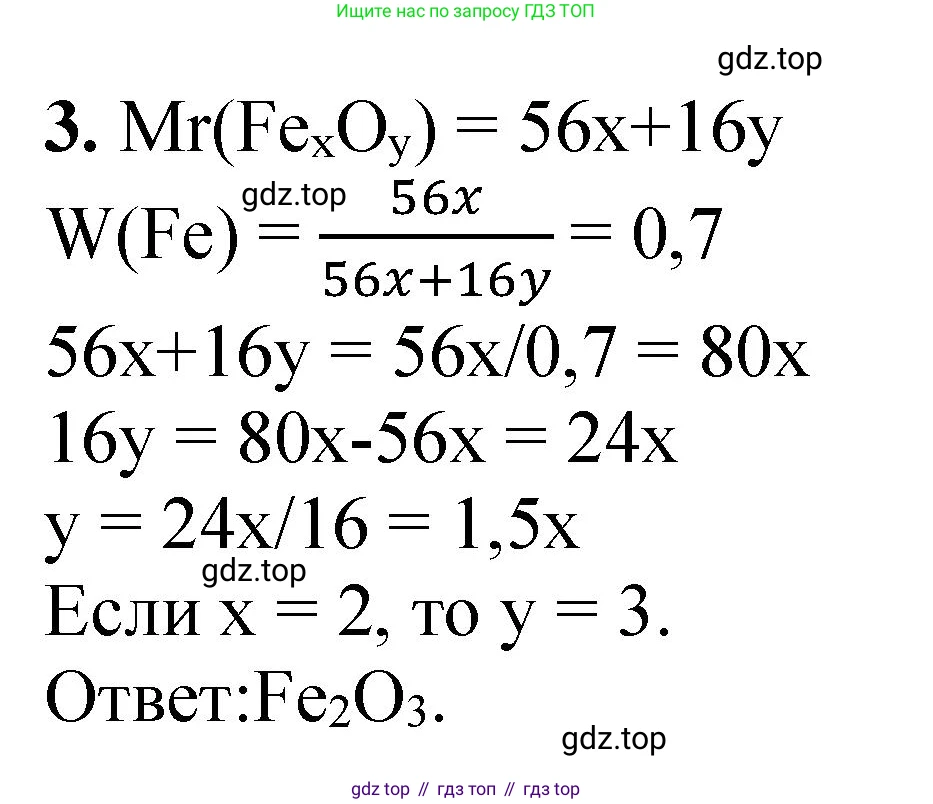
Решение 2. №3 (с. 202)
Дано:
Оксид железа $Fe_xO_y$
Массовая доля железа $\omega(Fe) = 70\%$
Найти:
Формулу оксида железа - $Fe_xO_y$
Решение:
Общая формула оксида железа $Fe_xO_y$, где x и y - индексы, показывающие количество атомов железа и кислорода в молекуле соответственно.
Поскольку соединение является оксидом, оно состоит только из железа и кислорода. Массовая доля кислорода в соединении будет равна:
$\omega(O) = 100\% - \omega(Fe) = 100\% - 70\% = 30\%$
Соотношение индексов в формуле химического соединения равно соотношению количеств вещества (числа молей) элементов, входящих в его состав:
$x : y = n(Fe) : n(O)$
Количество вещества ($n$) можно найти по формуле $n = \frac{m}{M}$, где $m$ - масса вещества, а $M$ - молярная масса (для атомов - относительная атомная масса, Ar).
Для удобства расчетов примем массу образца оксида равной 100 г. Тогда масса железа в нем составит:
$m(Fe) = 100 \text{ г} \cdot 0.70 = 70 \text{ г}$
А масса кислорода:
$m(O) = 100 \text{ г} \cdot 0.30 = 30 \text{ г}$
Теперь найдем количество вещества для каждого элемента. Используем относительные атомные массы из периодической таблицы: $Ar(Fe) \approx 56$ г/моль, $Ar(O) \approx 16$ г/моль.
$n(Fe) = \frac{m(Fe)}{Ar(Fe)} = \frac{70 \text{ г}}{56 \text{ г/моль}} = 1.25 \text{ моль}$
$n(O) = \frac{m(O)}{Ar(O)} = \frac{30 \text{ г}}{16 \text{ г/моль}} = 1.875 \text{ моль}$
Теперь найдем соотношение количеств вещества:
$x : y = n(Fe) : n(O) = 1.25 : 1.875$
Чтобы получить простейшее целочисленное соотношение, разделим оба числа на наименьшее из них (1.25):
$x : y = \frac{1.25}{1.25} : \frac{1.875}{1.25} = 1 : 1.5$
Так как индексы в формуле должны быть целыми числами, умножим полученное соотношение на 2, чтобы избавиться от дробного числа:
$x : y = (1 \cdot 2) : (1.5 \cdot 2) = 2 : 3$
Таким образом, простейшая формула оксида железа - $Fe_2O_3$. Это оксид железа(III) или гематит.
Проверим правильность вычислений. Найдем массовую долю железа в $Fe_2O_3$.
Молярная масса $M(Fe_2O_3) = 2 \cdot Ar(Fe) + 3 \cdot Ar(O) = 2 \cdot 56 + 3 \cdot 16 = 112 + 48 = 160$ г/моль.
Массовая доля железа $\omega(Fe) = \frac{2 \cdot Ar(Fe)}{M(Fe_2O_3)} \cdot 100\% = \frac{112}{160} \cdot 100\% = 0.7 \cdot 100\% = 70\%$.
Расчет верен.
Ответ: $Fe_2O_3$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 3 расположенного на странице 202 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 202), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















