Номер 16, страница 216 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 45. Медь - номер 16, страница 216.
№16 (с. 216)
Условие. №16 (с. 216)
скриншот условия
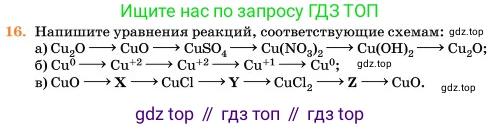
16. Напишите уравнения реакций, соответствующие схемам:
a) $Cu_2O \rightarrow CuO \rightarrow CuSO_4 \rightarrow Cu(NO_3)_2 \rightarrow Cu(OH)_2 \rightarrow Cu_2O$;
б) $Cu^0 \rightarrow Cu^{+2} \rightarrow Cu^{+2} \rightarrow Cu^{+1} \rightarrow Cu^0$;
в) $CuO \rightarrow \textbf{X} \rightarrow CuCl \rightarrow \textbf{Y} \rightarrow CuCl_2 \rightarrow \textbf{Z} \rightarrow CuO$.
Решение. №16 (с. 216)

Решение 2. №16 (с. 216)
а) Для осуществления данной цепи превращений можно использовать следующие реакции:
1. Окисление оксида меди(I) до оксида меди(II) кислородом при нагревании:
$2Cu_2O + O_2 \xrightarrow{t} 4CuO$
2. Реакция оксида меди(II) с серной кислотой с образованием сульфата меди(II):
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
3. Реакция ионного обмена между сульфатом меди(II) и растворимой солью бария, например, нитратом бария, для получения нитрата меди(II). Сульфат бария выпадает в осадок.
$CuSO_4 + Ba(NO_3)_2 \rightarrow Cu(NO_3)_2 + BaSO_4\downarrow$
4. Получение нерастворимого гидроксида меди(II) путем реакции нитрата меди(II) со щелочью:
$Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
5. Восстановление гидроксида меди(II) до оксида меди(I) с помощью альдегида, например, глюкозы (качественная реакция на альдегиды):
$2Cu(OH)_2 + C_6H_{12}O_6 \xrightarrow{t} Cu_2O\downarrow + C_6H_{12}O_7 + 2H_2O$
Ответ:
1. $2Cu_2O + O_2 \xrightarrow{t} 4CuO$
2. $CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
3. $CuSO_4 + Ba(NO_3)_2 \rightarrow Cu(NO_3)_2 + BaSO_4\downarrow$
4. $Cu(NO_3)_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaNO_3$
5. $2Cu(OH)_2 + C_6H_{12}O_6 \xrightarrow{t} Cu_2O\downarrow + C_6H_{12}O_7 + 2H_2O$
б) Данная схема отражает последовательность окислительно-восстановительных превращений меди. Можно предложить следующие реакции:
1. $Cu^0 \rightarrow Cu^{+2}$: Окисление металлической меди до иона $Cu^{+2}$ концентрированной азотной кислотой.
$Cu + 4HNO_3(\text{конц.}) \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
2. $Cu^{+2} \rightarrow Cu^{+2}$: Реакция, в которой медь не меняет степень окисления. Например, получение гидроксида меди(II) из соли.
$Cu(NO_3)_2 + 2KOH \rightarrow Cu(OH)_2\downarrow + 2KNO_3$
3. $Cu^{+2} \rightarrow Cu^{+1}$: Восстановление меди из степени окисления +2 в +1. Например, при реакции гидроксида меди(II) с восстановителем (глюкозой) образуется оксид меди(I).
$2Cu(OH)_2 + C_6H_{12}O_6 \xrightarrow{t} Cu_2O\downarrow + C_6H_{12}O_7 + 2H_2O$
4. $Cu^{+1} \rightarrow Cu^0$: Восстановление меди из степени окисления +1 в 0. Например, восстановление оксида меди(I) углем при нагревании.
$Cu_2O + C \xrightarrow{t} 2Cu + CO\uparrow$
Ответ:
1. $Cu + 4HNO_3(\text{конц.}) \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
2. $Cu(NO_3)_2 + 2KOH \rightarrow Cu(OH)_2\downarrow + 2KNO_3$
3. $2Cu(OH)_2 + C_6H_{12}O_6 \xrightarrow{t} Cu_2O\downarrow + C_6H_{12}O_7 + 2H_2O$
4. $Cu_2O + C \xrightarrow{t} 2Cu + CO\uparrow$
в) В данной схеме необходимо определить вещества X, Y и Z и написать уравнения реакций. Проанализировав цепочку превращений, можно предположить, что:
X - хлорид меди(II) ($CuCl_2$)
Y - сульфат меди(II) ($CuSO_4$)
Z - гидроксид меди(II) ($Cu(OH)_2$)
Тогда последовательность реакций будет следующей:
1. $CuO \rightarrow X (CuCl_2)$: Реакция оксида меди(II) с соляной кислотой.
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
2. $X (CuCl_2) \rightarrow CuCl$: Восстановление хлорида меди(II) до хлорида меди(I) с помощью металлической меди при нагревании.
$CuCl_2 + Cu \xrightarrow{t} 2CuCl$
3. $CuCl \rightarrow Y (CuSO_4)$: Окисление хлорида меди(I) концентрированной серной кислотой при нагревании.
$2CuCl + 2H_2SO_4(\text{конц.}) \xrightarrow{t} 2CuSO_4 + SO_2\uparrow + 2HCl\uparrow + 2H_2O$
4. $Y (CuSO_4) \rightarrow CuCl_2$: Реакция ионного обмена с хлоридом бария.
$CuSO_4 + BaCl_2 \rightarrow CuCl_2 + BaSO_4\downarrow$
5. $CuCl_2 \rightarrow Z (Cu(OH)_2)$: Осаждение гидроксида меди(II) щелочью.
$CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
6. $Z (Cu(OH)_2) \rightarrow CuO$: Термическое разложение гидроксида меди(II).
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
Ответ:
X - $CuCl_2$, Y - $CuSO_4$, Z - $Cu(OH)_2$.
1. $CuO + 2HCl \rightarrow CuCl_2 + H_2O$
2. $CuCl_2 + Cu \xrightarrow{t} 2CuCl$
3. $2CuCl + 2H_2SO_4(\text{конц.}) \xrightarrow{t} 2CuSO_4 + SO_2\uparrow + 2HCl\uparrow + 2H_2O$
4. $CuSO_4 + BaCl_2 \rightarrow CuCl_2 + BaSO_4\downarrow$
5. $CuCl_2 + 2NaOH \rightarrow Cu(OH)_2\downarrow + 2NaCl$
6. $Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 16 расположенного на странице 216 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №16 (с. 216), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















