Номер 1, страница 218 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 46. Серебро - номер 1, страница 218.
№1 (с. 218)
Условие. №1 (с. 218)
скриншот условия
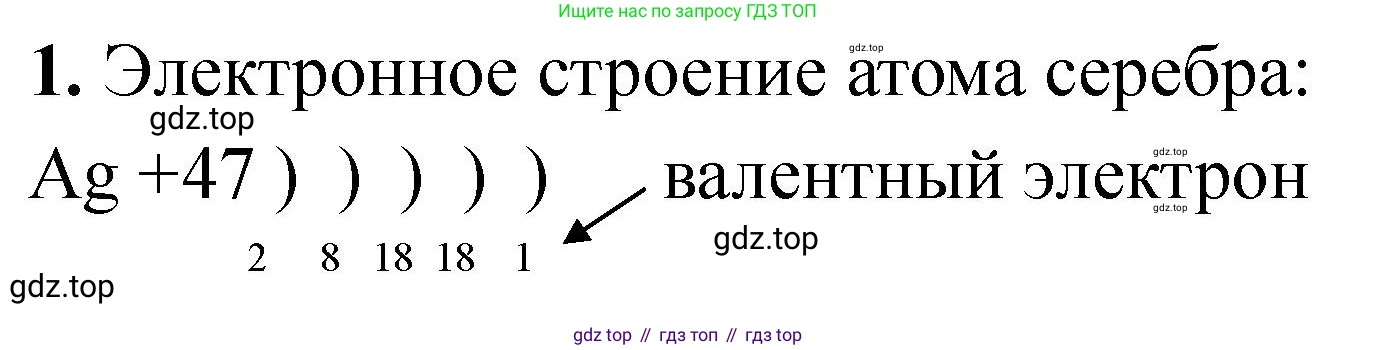
1. Напишите электронную конфигурацию атома серебра, зная, что на внешнем энергетическом уровне содержится один валентный электрон.
Решение. №1 (с. 218)
Решение 2. №1 (с. 218)
1. Напишите электронную конфигурацию атома серебра, зная, что на внешнем энергетическом уровне содержится один валентный электрон.
Решение
Серебро (Ag) – химический элемент с порядковым номером 47 в периодической системе Менделеева. Это означает, что в нейтральном атоме серебра содержится 47 протонов и 47 электронов.
Распределение электронов по орбиталям подчиняется принципу наименьшей энергии (правило Клечковского). Заполнение происходит в последовательности: $1s \rightarrow 2s \rightarrow 2p \rightarrow 3s \rightarrow 3p \rightarrow 4s \rightarrow 3d \rightarrow 4p \rightarrow 5s \rightarrow 4d \dots$
Если строго следовать этому правилу, электронная конфигурация серебра должна была бы быть $[Kr]4d^95s^2$, что в полной форме выглядит как $1s^22s^22p^63s^23p^63d^{10}4s^24p^64d^95s^2$. Однако такая конфигурация имела бы два электрона на внешнем, пятом энергетическом уровне ($5s^2$), что противоречит условию задачи.
У серебра, как и у других элементов 11-й группы (например, меди), наблюдается явление «провала» электрона. Это связано с тем, что полностью заполненный d-подуровень ($d^{10}$) является энергетически более выгодной и стабильной конфигурацией, чем почти заполненная ($d^9$). Поэтому один электрон с внешнего 5s-подуровня переходит на 4d-подуровень для достижения большей стабильности.
В результате этого процесса реальная конфигурация валентных электронов становится $4d^{10}5s^1$. На внешнем, пятом, энергетическом уровне остается один валентный электрон, что соответствует условию.
Полная электронная конфигурация атома серебра, записанная в порядке возрастания главного квантового числа, выглядит следующим образом: $1s^22s^22p^63s^23p^63d^{10}4s^24p^64d^{10}5s^1$.
Ответ: Электронная конфигурация атома серебра: $1s^22s^22p^63s^23p^63d^{10}4s^24p^64d^{10}5s^1$ или в сокращенном виде $[Kr]4d^{10}5s^1$.
2. Рассмотрите свойства серебра.
Решение
Свойства серебра (Ag) можно разделить на физические и химические.
Физические свойства:
Серебро — это пластичный, ковкий, блестящий металл серебристо-белого цвета. Оно обладает самой высокой среди всех металлов электро- и теплопроводностью. Серебро является тяжёлым металлом, его плотность составляет $10,49 \ г/см^3$. Температура плавления — $961,78 \ °C$, температура кипения — $2162 \ °C$.
Химические свойства:
Серебро — малоактивный, благородный металл. В электрохимическом ряду напряжений металлов оно стоит правее водорода.
- На чистом сухом воздухе серебро не окисляется, но со временем тускнеет в присутствии соединений серы (например, сероводорода $H_2S$), образуя черный налет сульфида серебра ($Ag_2S$): $4Ag + 2H_2S + O_2 \rightarrow 2Ag_2S \downarrow + 2H_2O$.
- Не реагирует с разбавленными соляной и серной кислотами, так как не способно вытеснять из них водород.
- Растворяется в кислотах-окислителях, таких как азотная кислота и концентрированная серная кислота (при нагревании):
$Ag + 2HNO_3(конц.) \rightarrow AgNO_3 + NO_2 \uparrow + H_2O$
$3Ag + 4HNO_3(разб.) \rightarrow 3AgNO_3 + NO \uparrow + 2H_2O$
$2Ag + 2H_2SO_4(конц., \ t°) \rightarrow Ag_2SO_4 + SO_2 \uparrow + 2H_2O$
- Реагирует с галогенами, образуя малорастворимые галогениды (кроме фторида). Например, с хлором: $2Ag + Cl_2 \rightarrow 2AgCl \downarrow$.
- Наиболее характерная и устойчивая степень окисления серебра +1, что обусловлено наличием одного валентного электрона на внешней 5s-орбитали.
Ответ: Серебро — это ковкий, пластичный металл с самой высокой электро- и теплопроводностью. Является химически малоактивным (благородным) металлом, не реагирует с неокисляющими кислотами, но растворяется в азотной и концентрированной серной кислотах. На воздухе тускнеет из-за образования сульфида серебра. Наиболее характерная степень окисления +1.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 218 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 218), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















