Номер 10, страница 219 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 4. Металлы побочных подгрупп. Параграф 46. Серебро - номер 10, страница 219.
№10 (с. 219)
Условие. №10 (с. 219)
скриншот условия
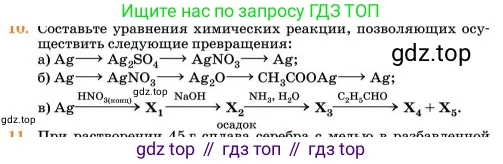
10. Составьте уравнения химических реакций, позволяющих осуществить следующие превращения:
a) $Ag \rightarrow Ag_2SO_4 \rightarrow AgNO_3 \rightarrow Ag;$
б) $Ag \rightarrow AgNO_3 \rightarrow Ag_2O \rightarrow CH_3COOAg \rightarrow Ag;$
в) $Ag \xrightarrow{HNO_{3(\text{конц})}} X_1 \xrightarrow{NaOH} \underset{\text{осадок}}{X_2} \xrightarrow{NH_3, H_2O} X_3 \xrightarrow{C_2H_5CHO} X_4 + X_5.$
Решение. №10 (с. 219)

Решение 2. №10 (с. 219)
a) 1. Для получения сульфата серебра из металлического серебра необходимо провести реакцию с концентрированной серной кислотой при нагревании, так как серебро является малоактивным металлом.
$2Ag + 2H_2SO_{4(конц.)} \xrightarrow{t} Ag_2SO_4 + SO_2\uparrow + 2H_2O$
2. Для превращения малорастворимого сульфата серебра в нитрат серебра используется реакция ионного обмена с растворимой солью, которая образует нерастворимый осадок с сульфат-ионом, например, с нитратом бария.
$Ag_2SO_4 + Ba(NO_3)_2 \rightarrow 2AgNO_3 + BaSO_4\downarrow$
3. Восстановление металлического серебра из раствора его соли (нитрата серебра) можно осуществить с помощью более активного металла, например, меди.
$2AgNO_3 + Cu \rightarrow Cu(NO_3)_2 + 2Ag\downarrow$
Ответ:
1) $2Ag + 2H_2SO_{4(конц.)} \xrightarrow{t} Ag_2SO_4 + SO_2\uparrow + 2H_2O$
2) $Ag_2SO_4 + Ba(NO_3)_2 \rightarrow 2AgNO_3 + BaSO_4\downarrow$
3) $2AgNO_3 + Cu \rightarrow Cu(NO_3)_2 + 2Ag\downarrow$
б) 1. Серебро реагирует с азотной кислотой (например, концентрированной) с образованием нитрата серебра.
$Ag + 2HNO_{3(конц.)} \rightarrow AgNO_3 + NO_2\uparrow + H_2O$
2. При добавлении щёлочи к раствору нитрата серебра выпадает осадок оксида серебра(I), поскольку образующийся гидроксид серебра($I$) неустойчив и сразу же разлагается.
$2AgNO_3 + 2NaOH \rightarrow Ag_2O\downarrow + 2NaNO_3 + H_2O$
3. Оксид серебра(I) проявляет основные свойства и реагирует с кислотами. С уксусной кислотой он образует соль — ацетат серебра.
$Ag_2O + 2CH_3COOH \rightarrow 2CH_3COOAg + H_2O$
4. Получить металлическое серебро из раствора его соли (ацетата серебра) можно вытеснением более активным металлом, например, цинком.
$2CH_3COOAg + Zn \rightarrow Zn(CH_3COO)_2 + 2Ag\downarrow$
Ответ:
1) $Ag + 2HNO_{3(конц.)} \rightarrow AgNO_3 + NO_2\uparrow + H_2O$
2) $2AgNO_3 + 2NaOH \rightarrow Ag_2O\downarrow + 2NaNO_3 + H_2O$
3) $Ag_2O + 2CH_3COOH \rightarrow 2CH_3COOAg + H_2O$
4) $2CH_3COOAg + Zn \rightarrow Zn(CH_3COO)_2 + 2Ag\downarrow$
в) 1. Взаимодействие серебра с концентрированной азотной кислотой приводит к образованию нитрата серебра ($X_1$).
$Ag + 2HNO_{3(конц.)} \rightarrow AgNO_3 + NO_2\uparrow + H_2O$
Вещество $X_1$ — нитрат серебра ($AgNO_3$).
2. Реакция нитрата серебра ($X_1$) с гидроксидом натрия приводит к образованию бурого осадка оксида серебра(I) ($X_2$).
$2AgNO_3 + 2NaOH \rightarrow Ag_2O\downarrow + 2NaNO_3 + H_2O$
Вещество $X_2$ — оксид серебра(I) ($Ag_2O$).
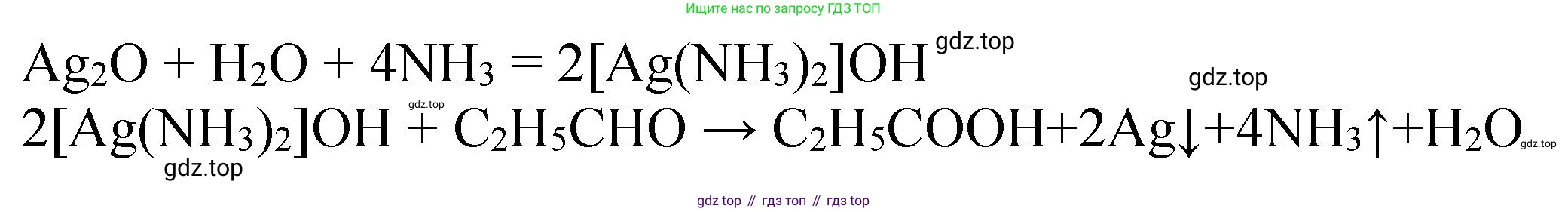
3. Оксид серебра(I) ($X_2$) растворяется в водном растворе аммиака с образованием комплексного соединения — гидроксида диамминсеребра(I) ($X_3$), известного как реактив Толленса.
$Ag_2O + 4(NH_3 \cdot H_2O) \rightarrow 2[Ag(NH_3)_2]OH + 3H_2O$
Вещество $X_3$ — гидроксид диамминсеребра(I) ($[Ag(NH_3)_2]OH$).
4. Реактив Толленса ($X_3$) окисляет альдегиды (в данном случае пропионовый альдегид $C_2H_5CHO$) до солей карбоновых кислот, при этом серебро восстанавливается до металлического состояния ($X_4$, "серебряное зеркало").
$C_2H_5CHO + 2[Ag(NH_3)_2]OH \rightarrow C_2H_5COONH_4 + 2Ag\downarrow + 3NH_3 + H_2O$
Вещество $X_4$ — серебро ($Ag$), вещество $X_5$ — пропаноат аммония ($C_2H_5COONH_4$).
Ответ:
Уравнения реакций:
1) $Ag + 2HNO_{3(конц.)} \rightarrow AgNO_3 + NO_2\uparrow + H_2O$
2) $2AgNO_3 + 2NaOH \rightarrow Ag_2O\downarrow + 2NaNO_3 + H_2O$
3) $Ag_2O + 4(NH_3 \cdot H_2O) \rightarrow 2[Ag(NH_3)_2]OH + 3H_2O$
4) $C_2H_5CHO + 2[Ag(NH_3)_2]OH \rightarrow C_2H_5COONH_4 + 2Ag\downarrow + 3NH_3 + H_2O$
Вещества: $X_1$ – $AgNO_3$; $X_2$ – $Ag_2O$; $X_3$ – $[Ag(NH_3)_2]OH$; $X_4$ – $Ag$; $X_5$ – $C_2H_5COONH_4$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 10 расположенного на странице 219 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №10 (с. 219), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















