Лабораторный опыт 17, страница 168 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 3. Металлы главных подгрупп. Параграф 35. Алюминий — химический элемент и простое вещество - страница 168.
Лабораторный опыт 17 (с. 168)
Условие. Лабораторный опыт 17 (с. 168)
скриншот условия

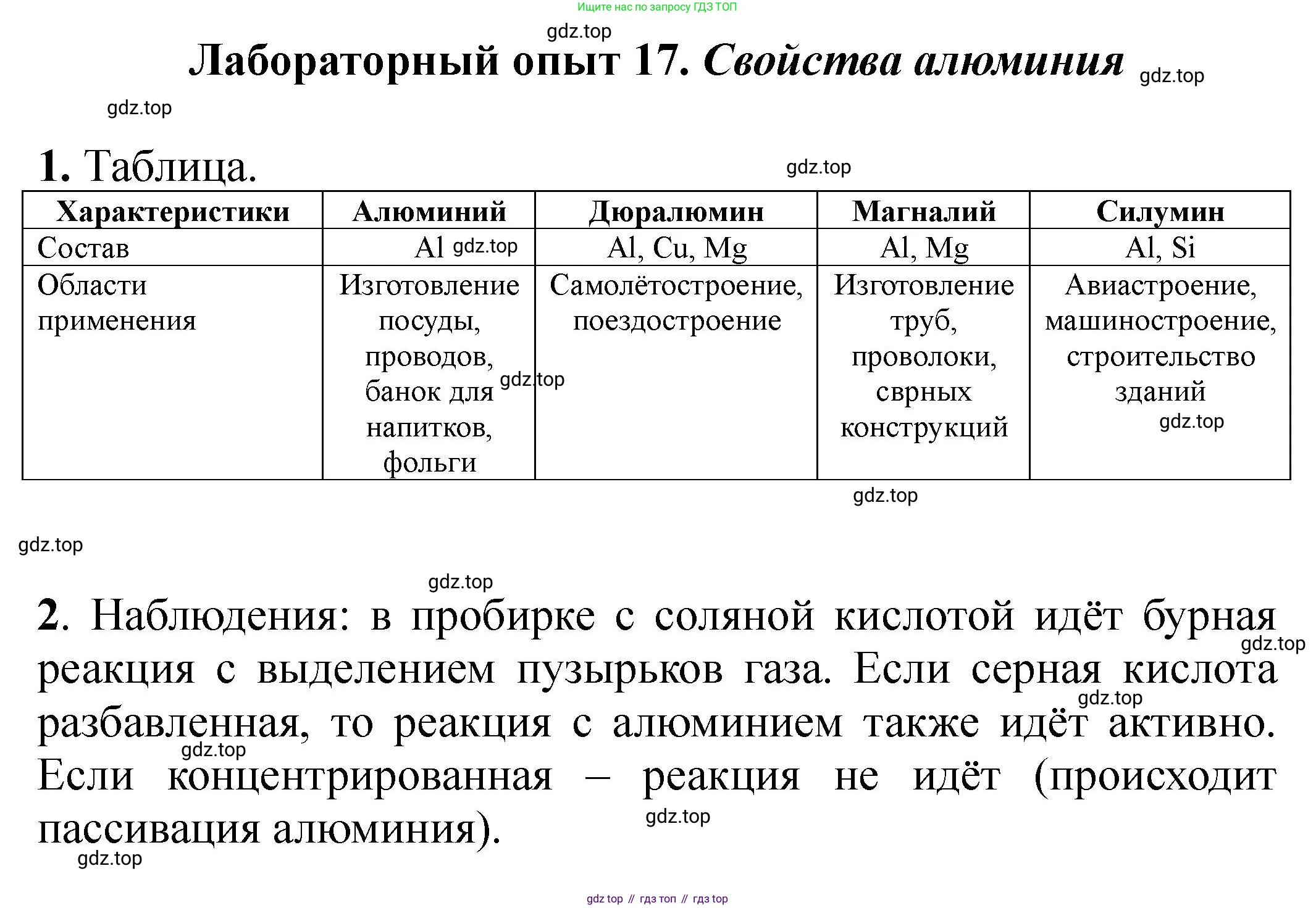
Лабораторный опыт 17. Свойства алюминия
1. Рассмотрите выданные вам образцы алюминия и его сплавов. Напишите в тетради название каждого сплава, его состав и области применения.
2. В две пробирки положите по 1–2 гранулы алюминия. В одну пробирку прилейте соляную кислоту, в другую — серную. Что вы наблюдаете? В каком случае реакция протекает более энергично?
Решение. Лабораторный опыт 17 (с. 168)
Решение 2. Лабораторный опыт 17 (с. 168)
1. Поскольку конкретные образцы сплавов не были предоставлены, в качестве примера рассмотрим наиболее распространенные сплавы алюминия:
Дюралюминий (дюраль)
Состав: основа – алюминий ($Al$); легирующие элементы – медь ($Cu$, 2,2–5,2 %), магний ($Mg$, 0,2–2,7 %), марганец ($Mn$, 0,2–1,0 %).
Области применения: авиастроение (фюзеляжи, крылья), ракетостроение, производство скоростных поездов и автомобилей. Отличается высокой прочностью при малой плотности.
Силумин
Состав: основа – алюминий ($Al$); основной легирующий элемент – кремний ($Si$, 4–22 %).
Области применения: литейное производство для изготовления деталей сложной формы, таких как блоки цилиндров двигателей, поршни, корпуса насосов, детали бытовой техники. Обладает отличными литейными свойствами.
Магналий
Состав: основа – алюминий ($Al$); основной легирующий элемент – магний ($Mg$, 1–13 %), иногда с добавками марганца ($Mn$).
Области применения: химическая промышленность, судостроение, производство деталей, требующих высокой коррозионной стойкости и хорошей свариваемости, а также в декоративных целях.
Ответ: Наиболее известными сплавами алюминия являются дюралюминий (применяется в авиации), силумин (используется в литейном производстве) и магналий (применяется там, где важна коррозионная стойкость). У каждого сплава свой уникальный состав, определяющий его свойства и области применения.
2. Наблюдения:
При добавлении соляной и серной кислот к гранулам алюминия в обеих пробирках наблюдается химическая реакция. Поверхность гранул покрывается пузырьками бесцветного газа без запаха, который активно выделяется в раствор. Это явление называется "вскипанием" или эффервесценцией. Со временем гранулы алюминия постепенно растворяются.
При сравнении интенсивности реакции можно заметить, что в пробирке с соляной кислотой ($HCl$) реакция протекает заметно энергичнее, чем в пробирке с серной кислотой ($H_2SO_4$) (при условии одинаковой концентрации и температуры кислот).
Объяснение:
Алюминий — химически активный металл, который в обычных условиях покрыт тонкой, но очень прочной и химически инертной оксидной пленкой ($Al_2O_3$). Эта пленка защищает металл от дальнейшего взаимодействия с окружающей средой. Чтобы реакция с кислотой началась, эта защитная пленка должна быть разрушена.
1. Взаимодействие с соляной кислотой:
Сначала кислота растворяет оксидную пленку:
$Al_2O_3 + 6HCl \rightarrow 2AlCl_3 + 3H_2O$
Затем кислота вступает в реакцию с очищенным от пленки алюминием, в результате чего выделяется водород:
$2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\uparrow$
2. Взаимодействие с серной кислотой (разбавленной):
Растворение оксидной пленки:
$Al_2O_3 + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2O$
Реакция с алюминием и выделение водорода:
$2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2\uparrow$
Реакция с соляной кислотой протекает более энергично, так как ионы хлора ($Cl^−$) являются активаторами коррозии и способны эффективно разрушать пассивную оксидную пленку на поверхности алюминия. Это обеспечивает более быстрый доступ кислоты к металлу. Сульфат-ионы ($SO_4^{2−}$) обладают этой способностью в меньшей степени.
Примечание: С концентрированной серной кислотой ($H_2SO_4$) при комнатной температуре реакция практически не идет, так как она пассивирует алюминий, то есть уплотняет и укрепляет его оксидную пленку.
Ответ: В обеих пробирках наблюдается выделение пузырьков газа (водорода) и растворение алюминия. Реакция протекает более энергично в пробирке с соляной кислотой, так как хлорид-ионы ($Cl^−$) эффективнее разрушают защитную оксидную пленку на поверхности алюминия.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения Лабораторный опыт 17 расположенного на странице 168 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Лабораторный опыт 17 (с. 168), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















