Номер 1, страница 438 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Практикум. Практическая работа - номер 1, страница 438.
№1 (с. 438)
Условие. №1 (с. 438)
скриншот условия

Практическая работа 1. Экспериментальное решение задач по теме «Галогены»
Реактивы: соляная кислота; хлориды цинка, натрия, бария; бромид натрия; иодиды натрия, калия; карбонаты натрия, магния; сульфат натрия; нитраты серебра, свинца(II); фосфат калия; хлорная вода; бромная вода; иодная вода; цинк; оксид магния; твёрдый карбонат натрия с примесью хлорида натрия; крахмальный клейстер; лакмус.
1. Получите раствор хлорида магния тремя различными способами. Напишите уравнения реакций в молекулярном и сокращённом ионном виде.
2. Докажите, что в состав соляной кислоты входят ионы водорода и хлорид-ионы.
3. Получите иодную воду из раствора иодида натрия (калия). Докажите образование иода при помощи качественной реакции.
4. Опытным путём докажите, что выданный образец карбоната натрия содержит примесь хлорида натрия.
5. В пронумерованных пробирках находятся растворы хлорида цинка, иодида калия, карбоната натрия, соляная кислота, иодная вода (в а р и а н т I); растворы хлорида натрия, иодида натрия, фосфата калия, бромная вода, соляная кислота (в а р и а н т II). Опытным путём определите, в какой пробирке находится каждый раствор. Напишите уравнения реакций.
6. Воспользовавшись реактивами, имеющимися на столе, проведите реакции, которым соответствуют следующие сокращённые ионные уравнения:
$Ag^+ + Br^- = AgBr\downarrow$
$Pb^{2+} + 2I^- = PbI_2\downarrow$
Решение. №1 (с. 438)


Решение 2. №1 (с. 438)
1. Получите раствор хлорида магния тремя различными способами. Напишите уравнения реакций в молекулярном и сокращённом ионном виде.
Для получения раствора хлорида магния ($MgCl_2$) можно использовать имеющиеся реактивы: оксид магния ($MgO$), карбонат магния ($MgCO_3$) и соляную кислоту ($HCl$).
Способ 1: Реакция основного оксида с кислотой.
К соляной кислоте добавляем порошок оксида магния. Оксид магния растворяется с образованием соли и воды.
- Молекулярное уравнение:
$MgO(тв) + 2HCl(р-р) = MgCl_2(р-р) + H_2O(ж)$ - Полное ионное уравнение:
$MgO(тв) + 2H^+ + 2Cl^- = Mg^{2+} + 2Cl^- + H_2O(ж)$ - Сокращённое ионное уравнение:
$MgO(тв) + 2H^+ = Mg^{2+} + H_2O(ж)$
Способ 2: Реакция соли слабой кислоты с сильной кислотой.
К соляной кислоте добавляем порошок карбоната магния. Наблюдается растворение осадка и выделение углекислого газа.
- Молекулярное уравнение:
$MgCO_3(тв) + 2HCl(р-р) = MgCl_2(р-р) + H_2O(ж) + CO_2(г)↑$ - Полное ионное уравнение:
$MgCO_3(тв) + 2H^+ + 2Cl^- = Mg^{2+} + 2Cl^- + H_2O(ж) + CO_2(г)↑$ - Сокращённое ионное уравнение:
$MgCO_3(тв) + 2H^+ = Mg^{2+} + H_2O(ж) + CO_2(г)↑$
Способ 3: Реакция вытеснения металла из соли менее растворимой соли.
К раствору хлорида цинка ($ZnCl_2$) добавляем твёрдый карбонат магния ($MgCO_3$). Происходит реакция ионного обмена с образованием растворимой соли хлорида магния и нерастворимого карбоната цинка, который является менее растворимым, чем карбонат магния.
- Молекулярное уравнение:
$MgCO_3(тв) + ZnCl_2(р-р) = MgCl_2(р-р) + ZnCO_3(тв)↓$ - Полное ионное уравнение:
$MgCO_3(тв) + Zn^{2+} + 2Cl^- = Mg^{2+} + 2Cl^- + ZnCO_3(тв)↓$ - Сокращённое ионное уравнение:
$MgCO_3(тв) + Zn^{2+} = Mg^{2+} + ZnCO_3(тв)↓$
Ответ: Раствор хлорида магния можно получить взаимодействием оксида магния или карбоната магния с соляной кислотой, а также взаимодействием карбоната магния с раствором хлорида цинка. Уравнения реакций приведены выше.
2. Докажите, что в состав соляной кислоты входят ионы водорода и хлорид-ионы.
Состав соляной кислоты ($HCl$) можно доказать с помощью качественных реакций на ионы водорода ($H^+$) и хлорид-ионы ($Cl^−$).
Доказательство наличия ионов водорода ($H^+$):
Ионы водорода определяют кислую среду раствора. Для их обнаружения используем индикатор лакмус. При добавлении нескольких капель раствора лакмуса к соляной кислоте, он изменит свой цвет на красный. Это свидетельствует о наличии ионов $H^+$ в растворе.
Доказательство наличия хлорид-ионов ($Cl^−$):
Для обнаружения хлорид-ионов используется реакция с нитратом серебра ($AgNO_3$). При добавлении раствора нитрата серебра к соляной кислоте выпадает белый творожистый осадок хлорида серебра ($AgCl$).
- Молекулярное уравнение:
$HCl(р-р) + AgNO_3(р-р) = AgCl(тв)↓ + HNO_3(р-р)$ - Сокращённое ионное уравнение:
$Ag^+ + Cl^- = AgCl(тв)↓$
Ответ: Наличие ионов $H^+$ в соляной кислоте доказывается изменением цвета лакмуса на красный. Наличие хлорид-ионов $Cl^−$ доказывается образованием белого творожистого осадка при добавлении раствора нитрата серебра.
3. Получите иодную воду из раствора иодида натрия (калия). Докажите образование иода при помощи качественной реакции.
Получение иодной воды:
Иодную воду (раствор иода $I_2$ в воде) можно получить, вытеснив иод из раствора его соли (например, иодида калия $KI$) более активным галогеном, например, хлором (в виде хлорной воды $Cl_2 (aq)$).
В пробирку с раствором иодида калия приливаем хлорную воду. Раствор окрашивается в бурый цвет из-за образования молекулярного иода.
- Молекулярное уравнение:
$2KI(р-р) + Cl_2(р-р) = 2KCl(р-р) + I_2(р-р)$ - Сокращённое ионное уравнение:
$2I^- + Cl_2 = 2Cl^- + I_2$
Доказательство образования иода:
Качественной реакцией на молекулярный иод является его взаимодействие с крахмалом. К полученному бурому раствору добавляем несколько капель крахмального клейстера. Появление интенсивного синего окрашивания подтверждает наличие иода в растворе.
Ответ: Иодную воду получают, действуя хлорной водой на раствор иодида калия. Образование иода доказывают с помощью крахмального клейстера, который в присутствии иода окрашивается в синий цвет.
4. Опытным путём докажите, что выданный образец карбоната натрия содержит примесь хлорида натрия.
Для обнаружения примеси хлорида натрия ($NaCl$) в карбонате натрия ($Na_2CO_3$) необходимо провести качественную реакцию на хлорид-ион. Прямое добавление нитрата серебра ($AgNO_3$) невозможно, так как и карбонат-ионы ($CO_3^{2−}$) будут давать осадок с ионами серебра ($Ag^+$). Поэтому необходимо сначала удалить карбонат-ионы, не вводя при этом в раствор хлорид-ионы. Стандартный метод с азотной кислотой невозможен из-за её отсутствия. Можно использовать следующий метод:
- Растворить образец (смесь $Na_2CO_3$ и $NaCl$) в дистиллированной воде.
- К полученному раствору добавить раствор нитрата свинца(II) ($Pb(NO_3)_2$). Выпадет белый осадок, который является смесью карбоната свинца(II) ($PbCO_3$) и хлорида свинца(II) ($PbCl_2$).
$CO_3^{2−} + Pb^{2+} → PbCO_3(тв)↓$
$2Cl^− + Pb^{2+} → PbCl_2(тв)↓$ - К пробирке с осадком осторожно прилить соляную кислоту ($HCl$). Карбонат свинца(II) прореагирует с кислотой и растворится с выделением газа, в то время как хлорид свинца(II) в соляной кислоте не растворится (из-за эффекта общего иона).
$PbCO_3(тв) + 2H^+ → Pb^{2+}(р-р) + H_2O(ж) + CO_2(г)↑$ - Если после добавления кислоты в пробирке остался белый осадок, это доказывает, что в его составе был хлорид свинца(II), а значит, в исходном образце присутствовали хлорид-ионы.
Ответ: Наличие примеси хлорида натрия доказывается в несколько стадий: осаждением ионов из раствора нитратом свинца(II), а затем селективным растворением карбонатного осадка в соляной кислоте. Нерастворившийся остаток хлорида свинца(II) подтверждает наличие хлорид-ионов в исходном образце.
5. В пронумерованных пробирках находятся растворы хлорида цинка, иодида калия, карбоната натрия, соляной кислоты, иодная вода (в а р и а н т I) ... Опытным путём определите, в какой пробирке находится каждый раствор. Напишите уравнения реакций.
Решение для варианта I: `ZnCl₂`, `KI`, `Na₂CO₃`, `HCl`, `I₂ (aq)`.
План определения веществ:
- Визуальный осмотр. Иодная вода ($I_2 (aq)$) — единственный окрашенный раствор (бурого цвета). Для подтверждения можно добавить к капле раствора крахмальный клейстер — появится характерное синее окрашивание.
- Идентификация остальных веществ. Остались четыре бесцветных раствора в пронумерованных пробирках: `ZnCl₂`, `KI`, `Na₂CO₃`, `HCl`. Отбираем из каждой пробирки пробы. Затем поочередно добавляем раствор из одной пробирки к трем другим, пока не найдем пробирку с карбонатом натрия.
- Обнаружение `Na₂CO₃`. Раствор `Na₂CO₃` является ключом к определению остальных веществ. Если к пробам других растворов добавить раствор `Na₂CO₃`, то:
- с соляной кислотой ($HCl$) будет наблюдаться бурное выделение газа (углекислого газа):
$Na_2CO_3(р-р) + 2HCl(р-р) → 2NaCl(р-р) + H_2O(ж) + CO_2(г)↑$
- с хлоридом цинка ($ZnCl_2$) выпадет белый осадок карбоната цинка:
$Na_2CO_3(р-р) + ZnCl_2(р-р) → ZnCO_3(тв)↓ + 2NaCl(р-р)$
- с иодидом калия ($KI$) видимых изменений не произойдет. - Определение всех веществ. Таким образом, пробирка, раствор из которой дает газ с одним из веществ и осадок с другим, содержит `Na₂CO₃`. Пробирка, давшая газ — `HCl`. Пробирка, давшая осадок — `ZnCl₂`. Оставшаяся пробирка содержит `KI`.
Ответ: Иодную воду определяют по цвету и реакции с крахмалом. Карбонат натрия определяют по реакциям с другими растворами (газ с кислотой, осадок с солью цинка). Затем идентифицируют кислоту и соль цинка. Оставшийся раствор — иодид калия.
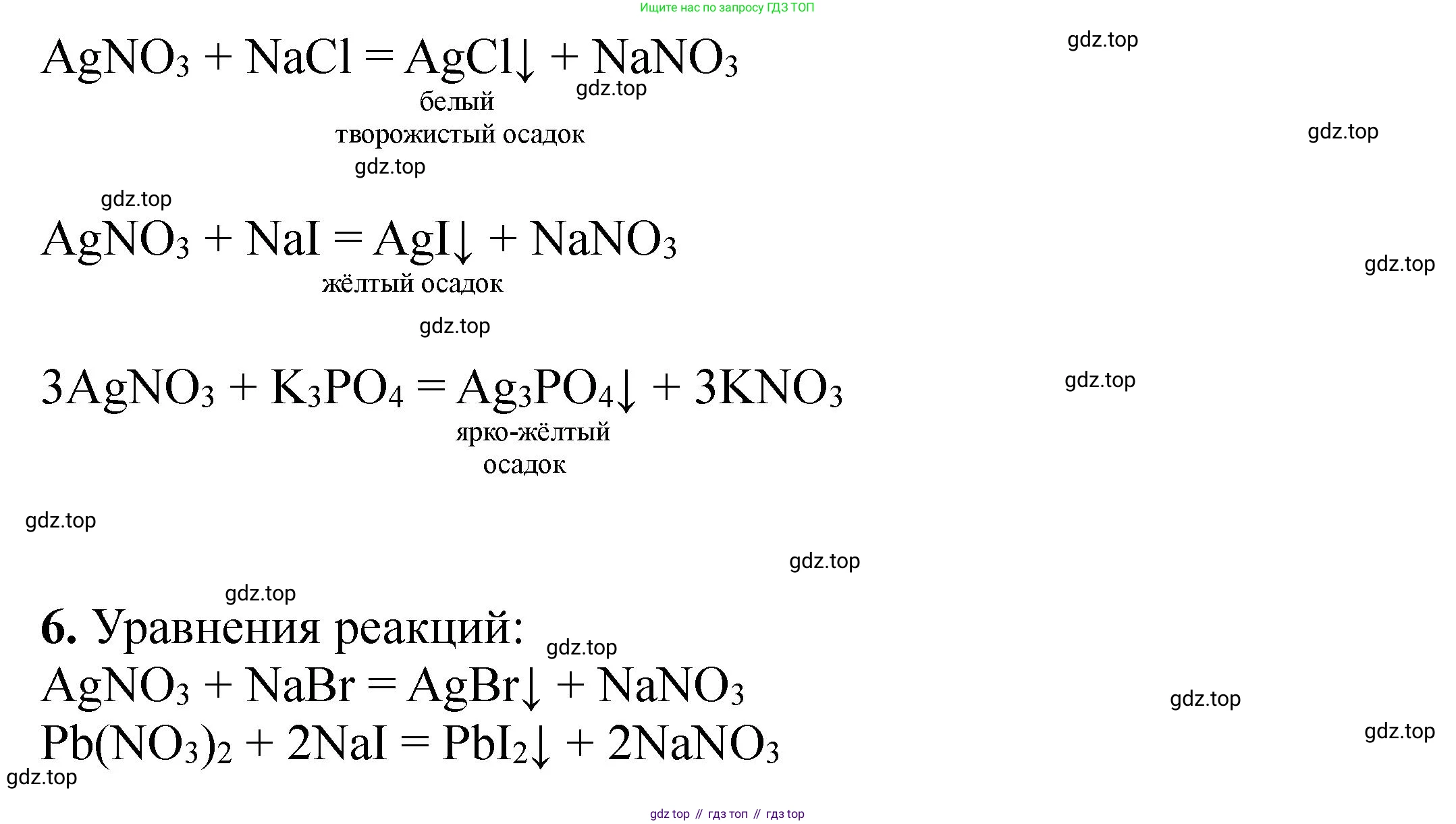
6. Воспользовавшись реактивами, имеющимися на столе, проведите реакции, которым соответствуют следующие сокращённые ионные уравнения: Ag⁺ + Br⁻ = AgBr↓; Pb²⁺ + 2I⁻ = PbI₂↓.
Для реакции $Ag^+ + Br^− = AgBr↓$:
Необходимо слить растворы, содержащие ионы $Ag^+$ и $Br^−$. Из имеющихся реактивов используем раствор нитрата серебра ($AgNO_3$) как источник ионов $Ag^+$ и раствор бромида натрия ($NaBr$) как источник ионов $Br^−$.
- Проведение реакции: К раствору бромида натрия прилить раствор нитрата серебра.
- Наблюдение: Образуется светло-желтый творожистый осадок бромида серебра ($AgBr$).
- Молекулярное уравнение реакции:
$AgNO_3(р-р) + NaBr(р-р) = AgBr(тв)↓ + NaNO_3(р-р)$
Для реакции $Pb^{2+} + 2I^− = PbI_2↓$:
Необходимо слить растворы, содержащие ионы $Pb^{2+}$ и $I^−$. Используем раствор нитрата свинца(II) ($Pb(NO_3)_2$) как источник ионов $Pb^{2+}$ и раствор иодида калия ($KI$) как источник ионов $I^−$.
- Проведение реакции: К раствору иодида калия прилить раствор нитрата свинца(II).
- Наблюдение: Образуется ярко-желтый кристаллический осадок иодида свинца(II) ($PbI_2$).
- Молекулярное уравнение реакции:
$Pb(NO_3)_2(р-р) + 2KI(р-р) = PbI_2(тв)↓ + 2KNO_3(р-р)$
Ответ: Для получения осадка $AgBr$ нужно смешать растворы нитрата серебра и бромида натрия. Для получения осадка $PbI_2$ нужно смешать растворы нитрата свинца(II) и иодида калия.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 438 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 438), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.
















