Номер 1, страница 49 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2025
Уровень обучения: базовый
Цвет обложки: белый, красный
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Вещество. Тестовые задания к главе 1 - номер 1, страница 49.
№1 (с. 49)
Условие. №1 (с. 49)
скриншот условия

1. Одинаковую электронную конфигурацию имеют
1) ионы $Mg^{2+}$ и $O^{2-}$
2) ионы $Na^{+}$ и $K^{+}$
3) ион $F^{-}$ и атом Ar
4) атомы O и S
Решение. №1 (с. 49)
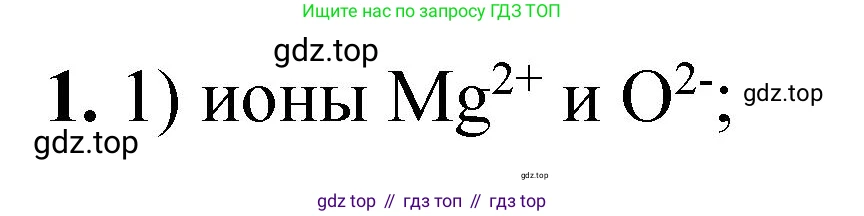
Решение 2. №1 (с. 49)
Чтобы определить, какая пара частиц имеет одинаковую электронную конфигурацию, необходимо сравнить количество электронов и их распределение по электронным оболочкам для каждой частицы в предложенных вариантах. Частицы с одинаковой электронной конфигурацией (изоэлектронные частицы) имеют одинаковое число электронов.
1) ионы Mg²⁺ и O²⁻
Атом магния (Mg) имеет порядковый номер 12, следовательно, у нейтрального атома 12 электронов. Электронная конфигурация атома Mg: $1s^2 2s^2 2p^6 3s^2$. При образовании катиона Mg²⁺ атом теряет два валентных электрона. Ион Mg²⁺ будет иметь $12 - 2 = 10$ электронов. Его электронная конфигурация: $1s^2 2s^2 2p^6$.
Атом кислорода (O) имеет порядковый номер 8, следовательно, у нейтрального атома 8 электронов. Электронная конфигурация атома O: $1s^2 2s^2 2p^4$. При образовании аниона O²⁻ атом принимает два электрона. Ион O²⁻ будет иметь $8 + 2 = 10$ электронов. Его электронная конфигурация: $1s^2 2s^2 2p^6$.
Ион Mg²⁺ и ион O²⁻ имеют одинаковое количество электронов (10) и одинаковую электронную конфигурацию ($1s^2 2s^2 2p^6$), соответствующую конфигурации благородного газа неона (Ne).
2) ионы Na⁺ и K⁺
Атом натрия (Na), №11, теряя один электрон, образует ион Na⁺ с $11 - 1 = 10$ электронами. Его конфигурация $1s^2 2s^2 2p^6$.
Атом калия (K), №19, теряя один электрон, образует ион K⁺ с $19 - 1 = 18$ электронами. Его конфигурация $1s^2 2s^2 2p^6 3s^2 3p^6$.
Эти ионы имеют разное количество электронов, а значит, и разные электронные конфигурации.
3) ион F⁻ и атом Ar
Атом фтора (F), №9, принимая один электрон, образует ион F⁻ с $9 + 1 = 10$ электронами. Его конфигурация $1s^2 2s^2 2p^6$.
Атом аргона (Ar), №18, является нейтральным атомом и имеет 18 электронов. Его конфигурация $1s^2 2s^2 2p^6 3s^2 3p^6$.
Эти частицы имеют разное количество электронов и разные электронные конфигурации.
4) атомы O и S
Атом кислорода (O), №8, имеет 8 электронов. Конфигурация $1s^2 2s^2 2p^4$.
Атом серы (S), №16, имеет 16 электронов. Конфигурация $1s^2 2s^2 2p^6 3s^2 3p^4$.
Хотя атомы O и S находятся в одной группе и имеют одинаковую конфигурацию внешнего электронного слоя ($ns^2 np^4$), их полные электронные конфигурации различны из-за разного числа электронных слоев.
Таким образом, проанализировав все варианты, мы установили, что одинаковую электронную конфигурацию имеет только пара ионов Mg²⁺ и O²⁻.
Ответ: 1
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 49 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 49), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), базовый уровень обучения учебного пособия издательства Просвещение.
















