Номер 4, страница 22 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава I. Важнейшие химические понятия и законы. Параграф 4. Распределение электронов в атомах элементов больших периодов. Подумайте, ответьте, выполните... - номер 4, страница 22.
№4 (с. 22)
Условие. №4 (с. 22)
скриншот условия

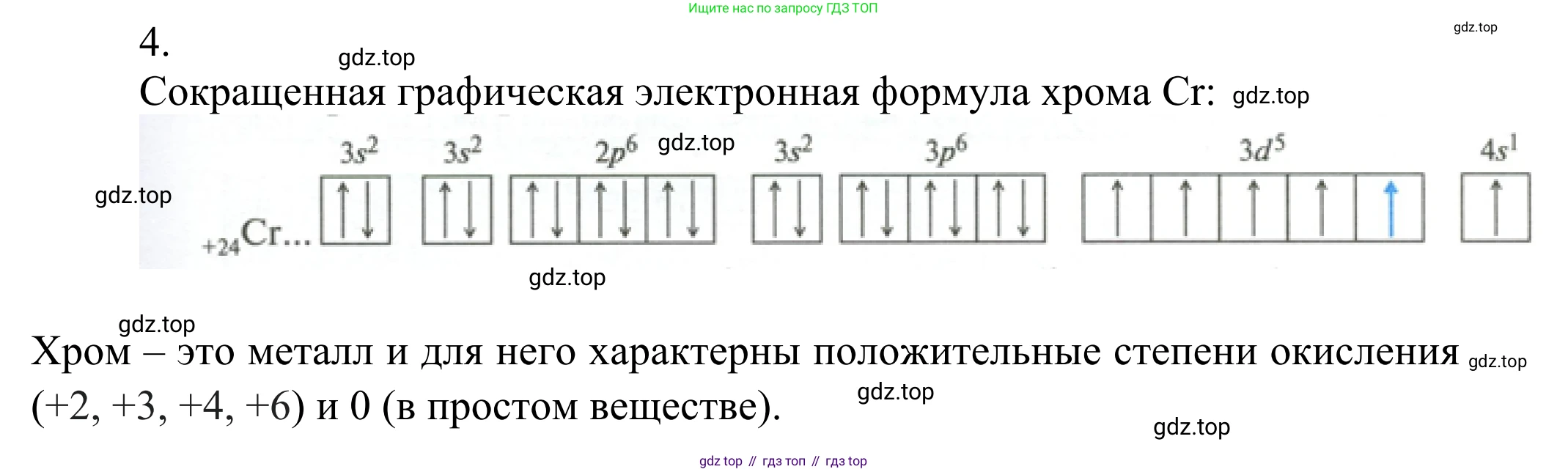
4. Используя графическую электронную схему атома хрома, приведённую в параграфе, определите, какие значения степени окисления могут быть характерны для этого элемента.
Решение. №4 (с. 22)
Решение 2. №4 (с. 22)
Решение
Чтобы определить возможные степени окисления хрома, необходимо проанализировать его электронное строение, в частности, конфигурацию валентных электронов.
Хром (Cr) — элемент 4-го периода, VI-Б группы, с порядковым номером 24. Его электронная конфигурация является исключением из правила Клечковского (принципа наименьшей энергии). Происходит "провал" одного электрона с 4s-подуровня на 3d-подуровень, что приводит к более устойчивой конфигурации с наполовину заполненными 3d- и 4s-подуровнями.
Электронная формула атома хрома: $Cr: 1s^22s^22p^63s^23p^63d^54s^1$.
Графическая схема валентных электронов атома хрома в основном (невозбужденном) состоянии выглядит так:
4s [↑]
Степень окисления определяется числом электронов, которые атом отдает при образовании химических связей. У хрома валентными являются все электроны на внешнем 4s- и предвнешнем 3d-подуровнях.
Общее число валентных электронов у хрома составляет $1 (с 4s) + 5 (с 3d) = 6$. Это означает, что максимальная степень окисления хрома равна +6, когда он отдает все свои валентные электроны.
Хром может проявлять и другие, более низкие, положительные степени окисления, отдавая часть своих валентных электронов:
- Отдавая 1 электрон (с 4s-орбитали), хром проявляет степень окисления +1 (встречается редко).
- Отдавая 2 электрона (один 4s- и один 3d-), хром проявляет степень окисления +2 (характерна для соединений, обладающих восстановительными свойствами, например, $CrO$).
- Отдавая 3 электрона (один 4s- и два 3d-), хром проявляет свою наиболее устойчивую степень окисления +3 (образует амфотерные соединения, например, $Cr_2O_3$).
- Степени окисления +4 и +5 также возможны, но менее характерны.
- Отдавая все 6 валентных электронов, хром проявляет высшую степень окисления +6 (характерна для сильных окислителей, например, в оксиде $CrO_3$, хроматах $K_2CrO_4$ и дихроматах $K_2Cr_2O_7$).
Таким образом, на основе анализа его электронной конфигурации, для хрома возможны степени окисления от +1 до +6.
Ответ: для элемента хрома могут быть характерны степени окисления +1, +2, +3, +4, +5, +6. Наиболее устойчивыми и распространенными являются +2, +3 и +6.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 22 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 22), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















