Номер 1, страница 43 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава II. Строение вещества. Параграф 9. Пространственное строение молекул. Подумайте, ответьте, выполните... - номер 1, страница 43.
№1 (с. 43)
Условие. №1 (с. 43)
скриншот условия

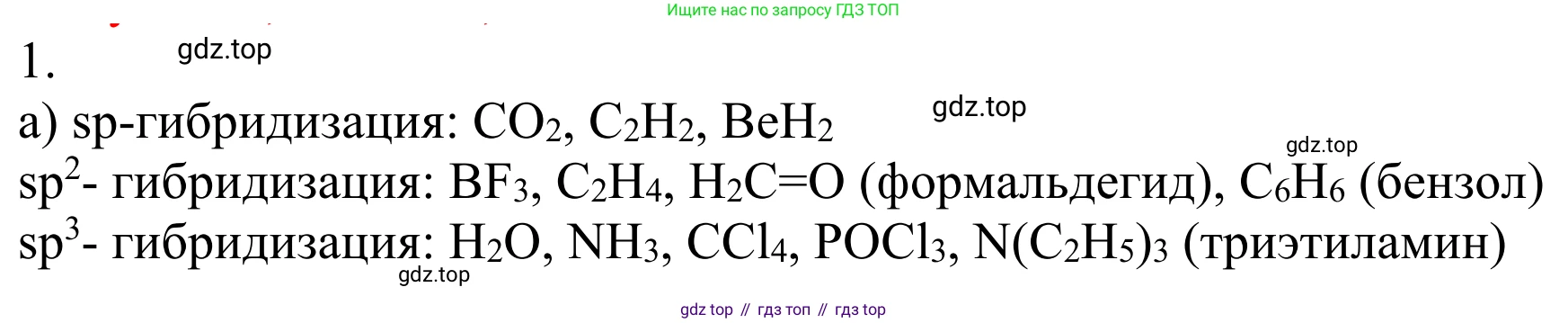
1. Приведите примеры образования молекул органических и неорганических веществ на основе $sp$-, $sp^2$- и $sp^3$-гибридизации.
Решение. №1 (с. 43)
Решение 2. №1 (с. 43)
Гибридизация атомных орбиталей — это гипотетический процесс смешения и выравнивания по энергии и форме различных атомных орбиталей центрального атома многоатомной молекулы, в результате которого образуются новые, одинаковые (гибридные) орбитали. Тип гибридизации определяет пространственное строение молекулы.
sp³-гибридизация
Этот тип гибридизации возникает при смешении одной s-орбитали и трёх p-орбиталей. В результате образуются четыре равноценные гибридные sp³-орбитали, которые направлены к вершинам тетраэдра. Угол между осями этих орбиталей составляет $109.5^\circ$. sp³-гибридизация характерна для атомов, образующих четыре одинарные (сигма, $\sigma$) связи.
Примеры органических веществ:
Метан ($CH_4$). Атом углерода находится в состоянии sp³-гибридизации. Четыре гибридные орбитали углерода перекрываются с 1s-орбиталями четырёх атомов водорода, образуя четыре прочные $\sigma$-связи C-H. Молекула имеет форму правильного тетраэдра.
Этан ($C_2H_6$). Каждый из двух атомов углерода находится в состоянии sp³-гибридизации. Одна гибридная орбиталь каждого атома углерода образует $\sigma$-связь C-C, а остальные три — $\sigma$-связи C-H. Тетраэдрическое строение сохраняется вокруг каждого атома углерода.
Примеры неорганических веществ:
Аммиак ($NH_3$). Атом азота sp³-гибридизован. Три гибридные орбитали участвуют в образовании $\sigma$-связей N-H, а на четвёртой находится неподелённая электронная пара. Из-за отталкивания этой пары валентный угол H-N-H ($107.8^\circ$) несколько меньше тетраэдрического. Молекула имеет форму тригональной пирамиды.
Вода ($H_2O$). Атом кислорода также находится в sp³-гибридизации. Две гибридные орбитали образуют $\sigma$-связи O-H, а на двух других находятся две неподелённые электронные пары. Их сильное взаимное отталкивание сжимает валентный угол H-O-H до $104.5^\circ$. Молекула имеет угловое строение.
Ион аммония ($NH_4^+$). Атом азота sp³-гибридизован и образует четыре ковалентные связи с атомами водорода, что приводит к тетраэдрической структуре.
Ответ: Примеры sp³-гибридизации: органические — метан ($CH_4$), этан ($C_2H_6$); неорганические — аммиак ($NH_3$), вода ($H_2O$), ион аммония ($NH_4^+$).
sp²-гибридизация
Возникает при смешении одной s- и двух p-орбиталей. Образуются три равноценные гибридные sp²-орбитали, которые лежат в одной плоскости под углом $120^\circ$ друг к другу. Одна p-орбиталь остается негибридизованной и расположена перпендикулярно плоскости гибридных орбиталей. sp²-гибридизация характерна для атомов, образующих двойную связь (одну $\sigma$- и одну пи, $\pi$-связь).
Примеры органических веществ:
Этилен ($C_2H_4$). Оба атома углерода находятся в состоянии sp²-гибридизации. Две sp²-орбитали (по одной от каждого атома С) образуют $\sigma$-связь C-C. Остальные четыре sp²-орбитали образуют $\sigma$-связи C-H. Негибридизованные p-орбитали обоих атомов углерода перекрываются, образуя $\pi$-связь. Молекула плоская.
Бензол ($C_6H_6$). Все шесть атомов углерода в цикле находятся в sp²-гибридизации. Каждый атом углерода образует три $\sigma$-связи (две C-C и одну C-H). Шесть негибридизованных p-орбиталей образуют единую сопряженную $\pi$-систему над и под плоскостью кольца.
Примеры неорганических веществ:
Трифторид бора ($BF_3$). Центральный атом бора находится в состоянии sp²-гибридизации. Три его гибридные орбитали образуют три $\sigma$-связи B-F. Молекула имеет форму плоского треугольника с углами $120^\circ$.
Графит (C). В кристаллической решетке графита каждый атом углерода sp²-гибридизован и связан с тремя соседними атомами в одной плоскости, образуя гексагональные слои. Негибридизованные p-орбитали создают делокализованную $\pi$-систему между слоями.
Ответ: Примеры sp²-гибридизации: органические — этилен ($C_2H_4$), бензол ($C_6H_6$); неорганические — трифторид бора ($BF_3$), графит (C).
sp-гибридизация
Происходит при смешении одной s- и одной p-орбитали. Образуются две равноценные гибридные sp-орбитали, расположенные на одной прямой под углом $180^\circ$ друг к другу. Две p-орбитали остаются негибридизованными и располагаются во взаимно перпендикулярных плоскостях. sp-гибридизация характерна для атомов, образующих тройную связь (одна $\sigma$- и две $\pi$-связи) или две двойные связи.
Примеры органических веществ:
Ацетилен ($C_2H_2$). Оба атома углерода находятся в состоянии sp-гибридизации. Они образуют $\sigma$-связь C-C путем перекрывания sp-орбиталей. Другие sp-орбитали образуют $\sigma$-связи C-H. Две пары негибридизованных p-орбиталей перекрываются, образуя две взаимно перпендикулярные $\pi$-связи. Молекула имеет линейное строение.
Примеры неорганических веществ:
Диоксид углерода ($CO_2$). Центральный атом углерода находится в состоянии sp-гибридизации. Он образует две $\sigma$-связи с атомами кислорода с помощью своих sp-орбиталей. Две негибридизованные p-орбитали углерода образуют две $\pi$-связи с p-орбиталями атомов кислорода. Молекула линейная.
Гидрид бериллия ($BeH_2$). Атом бериллия sp-гибридизован. Две sp-орбитали образуют две $\sigma$-связи Be-H. Молекула линейная.
Ответ: Примеры sp-гибридизации: органические — ацетилен ($C_2H_2$); неорганические — диоксид углерода ($CO_2$), гидрид бериллия ($BeH_2$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 43 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 43), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















