Номер 4, страница 43 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2026
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава II. Строение вещества. Параграф 9. Пространственное строение молекул. Подумайте, ответьте, выполните... - номер 4, страница 43.
№4 (с. 43)
Условие. №4 (с. 43)
скриншот условия

4. Составьте структурную формулу четырёххлористого углерода. Определите вид химической связи в этом соединении, тип гибридизации орбиталей атома углерода и форму молекулы.
Решение. №4 (с. 43)
Решение 2. №4 (с. 43)
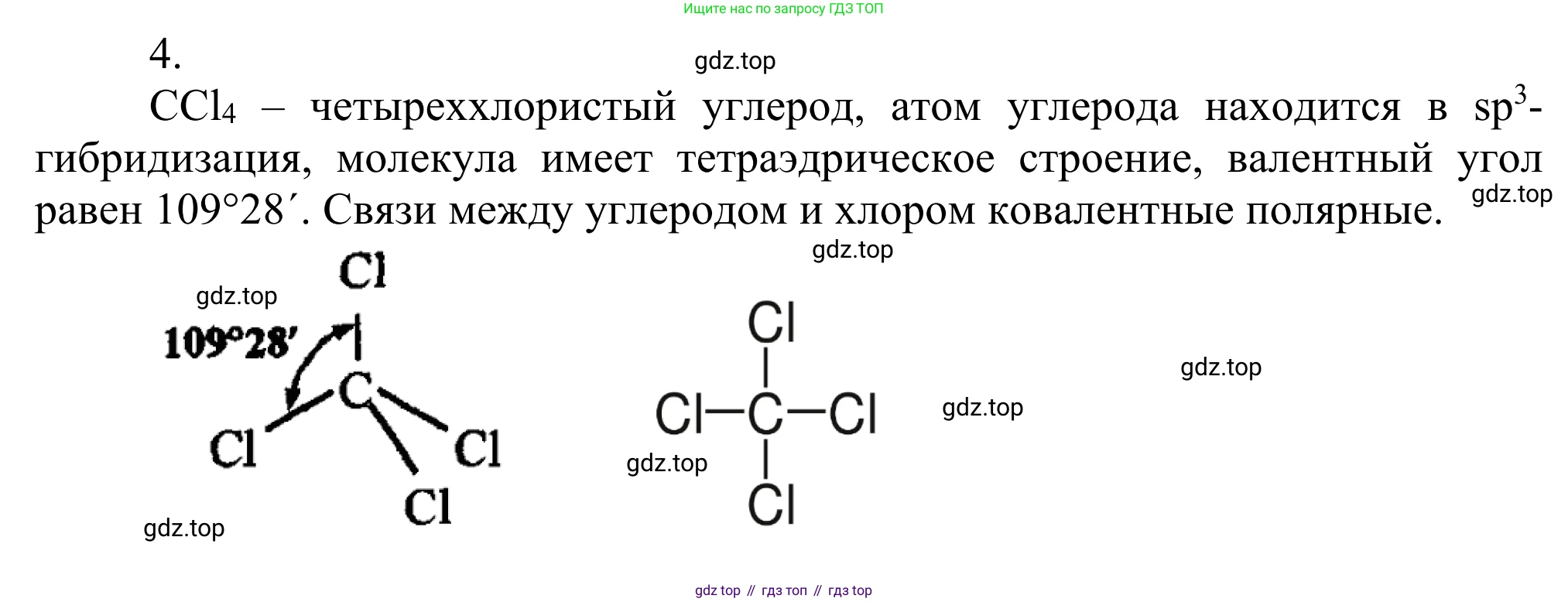
Для решения задачи проанализируем строение молекулы четырёххлористого углерода ($CCl_4$) по пунктам.
1. Структурная формулаХимическая формула четырёххлористого углерода — $CCl_4$. В его молекуле один атом углерода (C), являющийся центральным, образует четыре одинарные связи с четырьмя атомами хлора (Cl).
Структурная формула выглядит следующим образом:
Cl
|
Cl–C–Cl
|
Cl
Ответ: Структурная формула $CCl_4$ представляет собой центральный атом углерода, соединённый одинарными связями с четырьмя атомами хлора.
2. Вид химической связиСвязь в молекуле $CCl_4$ образуется между атомами углерода и хлора. Оба этих элемента являются неметаллами, следовательно, связь между ними — ковалентная. Электроотрицательность хлора (по Полингу ≈ 3,16) значительно выше электроотрицательности углерода (≈ 2,55). Разница электроотрицательностей составляет $3,16 - 2,55 = 0,61$. Из-за этой разницы общая электронная пара смещается в сторону атома хлора, что делает связь C-Cl полярной.
Ответ: Ковалентная полярная связь.
3. Тип гибридизации орбиталей атома углеродаАтом углерода имеет электронную конфигурацию в основном состоянии $1s^2 2s^2 2p^2$. Для образования четырёх связей он переходит в возбуждённое состояние: один электрон с 2s-орбитали переходит на свободную 2p-орбиталь. Конфигурация становится $1s^2 2s^1 2p^3$. В процессе гибридизации одна s-орбиталь и три p-орбитали смешиваются, образуя четыре равноценные гибридные орбитали. Такой тип гибридизации называется $sp^3$-гибридизацией. Каждая из этих четырёх гибридных орбиталей участвует в образовании $\sigma$-связи с атомом хлора.
Ответ: $sp^3$-гибридизация.
4. Форма молекулыНаличие у центрального атома углерода четырёх $sp^3$-гибридных орбиталей, участвующих в образовании четырёх $\sigma$-связей, и отсутствие неподелённых электронных пар приводят к определённой геометрии. Согласно теории отталкивания электронных пар валентной оболочки (VSEPR), для минимизации взаимного отталкивания четыре связи располагаются в пространстве под углом друг к другу, направляясь к вершинам правильного тетраэдра. Поэтому молекула четырёххлористого углерода имеет тетраэдрическую форму. Валентный угол Cl–C–Cl составляет $109,5^{\circ}$ (или $109^{\circ}28'$).
Ответ: Тетраэдрическая.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 4 расположенного на странице 43 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 43), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















