Номер 3, страница 134 - гдз по химии 11 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: розовый
ISBN: 978-5-09-088085-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава VI. Металлы. Параграф 28. Общий обзор металлических элементов Б-групп. Подумайте, ответьте, выполните... - номер 3, страница 134.
№3 (с. 134)
Условие. №3 (с. 134)
скриншот условия

3. Сравните строение атомов и свойства калия и меди и поясните, в чём проявляются сходство и различия элементов IA- и IB-групп.
Решение. №3 (с. 134)
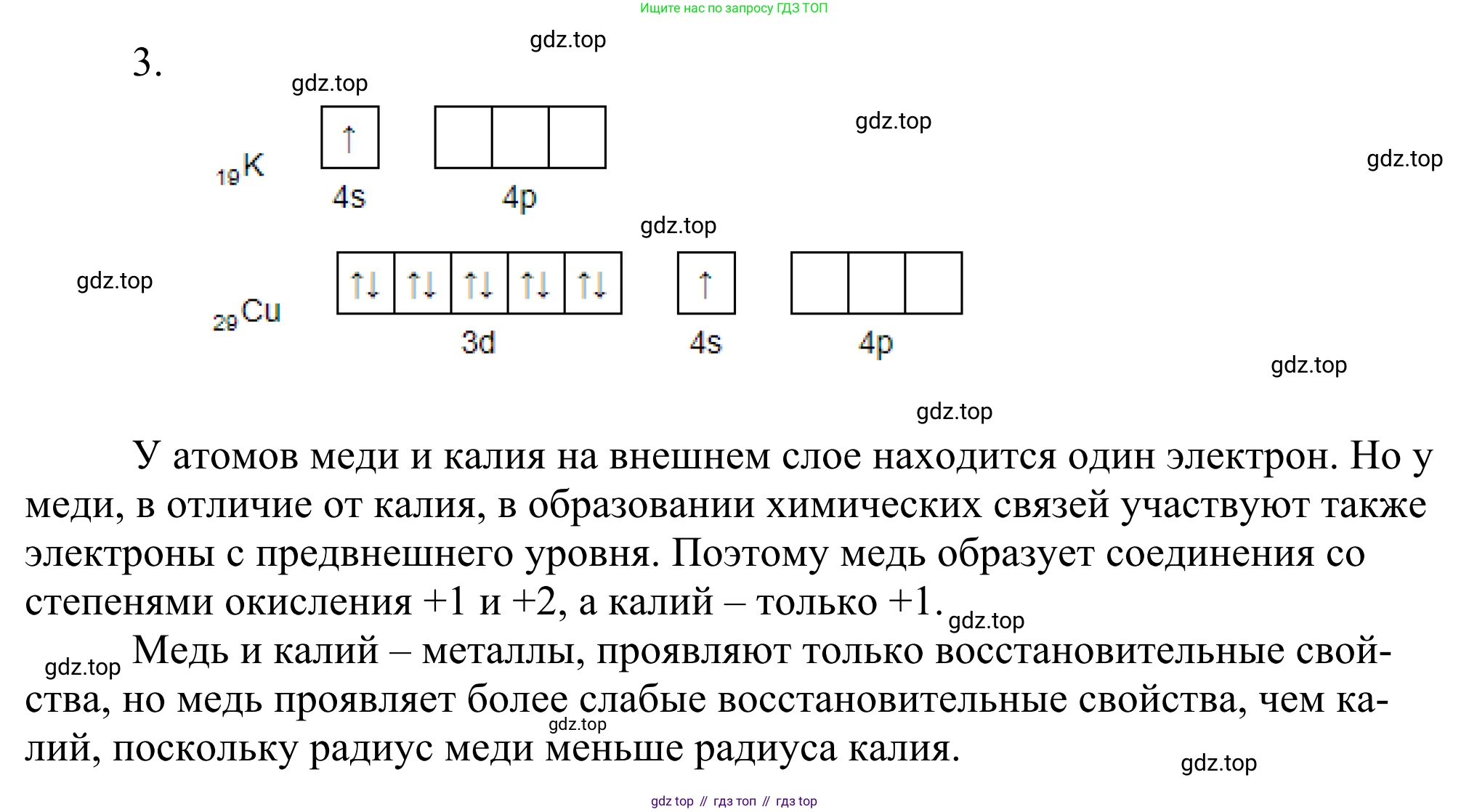
Решение 2. №3 (с. 134)
Для сравнения строения атомов и свойств калия (K) и меди (Cu), а также для объяснения сходства и различий элементов IA- и IБ-групп, необходимо рассмотреть их электронные конфигурации и положение в Периодической системе.
Сравнение строения атомов и свойств калия и меди
Калий (K) — элемент 4-го периода, IA-группы (главной подгруппы I группы). Медь (Cu) — элемент 4-го периода, IБ-группы (побочной подгруппы I группы).
Строение атомов
- Атом калия имеет порядковый номер 19, заряд ядра +19. Его электронная конфигурация: $ _{19}K \quad 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 $ или в сокращенном виде $ [Ar] 4s^1 $.
- Атом меди имеет порядковый номер 29, заряд ядра +29. Его электронная конфигурация: $ _{29}Cu \quad 1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^1 $ или в сокращенном виде $ [Ar] 3d^{10} 4s^1 $. У меди наблюдается "провал" электрона с 4s- на 3d-подуровень для достижения более устойчивой конфигурации с полностью завершенным 3d-подуровнем.
Сходство в строении:
Главное сходство заключается в том, что на внешнем, четвертом, энергетическом уровне у атомов обоих элементов находится по одному электрону ($4s^1$). Это формальное сходство и является причиной, по которой оба элемента относят к I группе.
Различия в строении:
- Заряд ядра и общее число электронов: У меди заряд ядра (+29) и число электронов (29) значительно больше, чем у калия (+19 и 19).
- Строение предвнешнего электронного слоя: У калия предвнешний слой (третий) содержит 8 электронов ($3s^2 3p^6$) и является завершенным. У меди предвнешний слой также третий, но он содержит 18 электронов ($3s^2 3p^6 3d^{10}$) и имеет полностью заполненный d-подуровень.
Свойства простых веществ и соединений
Различия в строении атомов приводят к существенным различиям в свойствах.
Сходство в свойствах:
- И калий, и медь являются металлами.
- Оба элемента могут проявлять степень окисления +1, отдавая свой единственный внешний s-электрон. Например, образуют оксиды $K_2O$ и $Cu_2O$.
Различия в свойствах:
- Химическая активность: Калий — щелочной металл, очень активный, бурно реагирует с водой, является сильным восстановителем. Медь — малоактивный, "благородный" металл, с водой не реагирует, стоит в ряду напряжений после водорода.
- Радиус атома: Несмотря на нахождение в одном периоде, атомный радиус меди (128 пм) заметно меньше радиуса атома калия (227 пм). Это связано с гораздо большим зарядом ядра у меди, который сильнее притягивает электроны.
- Степени окисления: Для калия характерна только одна степень окисления: +1. Медь, помимо степени окисления +1, проявляет более устойчивую и распространенную степень окисления +2 (за счет отрыва электрона с 3d-подуровня).
- Свойства ионов: Ион $K^+$ бесцветен. Ионы меди в степени окисления +1 ($Cu^+$) в водных растворах неустойчивы, а ионы $Cu^{2+}$ устойчивы и имеют характерную голубую или синюю окраску.
- Комплексообразование: Ионы меди, особенно $Cu^{2+}$, склонны к образованию прочных комплексных соединений (например, $[Cu(NH_3)_4]^{2+}$). Для иона калия комплексообразование нехарактерно.
Объяснение сходства и различий элементов IA- и IБ-групп
Сравнение калия и меди наглядно иллюстрирует общие закономерности для элементов IA- и IБ-групп.
Сходство элементов этих подгрупп является в значительной степени формальным. Оно обусловлено наличием одного электрона на внешней s-орбитали ($ns^1$). Это определяет их общую валентность, равную I, и способность образовывать соединения в степени окисления +1.
Различия гораздо более существенны и определяются строением предвнешнего электронного слоя:
- У элементов IA-группы (щелочные металлы) предвнешний слой содержит 8 электронов. Это устойчивая конфигурация инертного газа. Поэтому они легко отдают единственный внешний электрон, проявляя только степень окисления +1, и являются очень сильными восстановителями.
- У элементов IБ-группы (медь, серебро, золото) предвнешний слой содержит 18 электронов, включая полностью заполненный d-подуровень ($(n-1)d^{10}$). Электроны d-подуровня слабо экранируют заряд ядра, поэтому внешний s-электрон притягивается к ядру значительно сильнее, чем у щелочных металлов того же периода. Это приводит к меньшему радиусу, большей энергии ионизации и, как следствие, к низкой химической активности. Кроме того, d-электроны могут участвовать в образовании химических связей, что обуславливает для этих элементов переменные степени окисления (например, +2, +3).
Ответ: Сходство строения атомов калия и меди (и в целом элементов IA- и IБ-групп) заключается в наличии одного электрона на внешнем энергетическом уровне ($ns^1$), что обуславливает их принадлежность к I группе и возможность проявлять степень окисления +1. Различия заключаются в строении предвнешнего электронного слоя (8-электронный у K и 18-электронный у Cu), что кардинально влияет на их свойства. Калий — типичный s-элемент, щелочной металл с высокой активностью и единственной степенью окисления +1. Медь — d-элемент, малоактивный металл с переменными степенями окисления (+1, +2), склонный к комплексообразованию.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 3 расположенного на странице 134 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 134), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.

















