Номер 2, страница 66 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 1. Атомы химических элементов. Параграф 10. Ионная химическая связь - номер 2, страница 66.
№2 (с. 66)
Условие. №2 (с. 66)

Решение. №2 (с. 66)

Решение 2. №2 (с. 66)
Ионная связь возникает между атомами, которые сильно отличаются по электроотрицательности, как правило, между типичным металлом и типичным неметаллом. В процессе образования связи атом металла отдает свои валентные электроны, превращаясь в положительно заряженный ион (катион), а атом неметалла принимает эти электроны, превращаясь в отрицательно заряженный ион (анион). Возникающее между разноименно заряженными ионами электростатическое притяжение и есть ионная связь.
а) калия и кислородаРешение
Калий ($K$) — это щелочной металл, находящийся в 1-й группе периодической системы. Его атом имеет один валентный электрон на внешнем энергетическом уровне. Для достижения стабильной электронной конфигурации (как у инертного газа аргона) атому калия энергетически выгодно отдать этот электрон.
Процесс превращения атома калия в ион (катион):
$K^0 - 1e^- \rightarrow K^+$
Кислород ($O$) — это неметалл, находящийся в 16-й группе. Его атому с шестью валентными электронами для завершения внешнего уровня до стабильных восьми электронов (как у инертного газа неона) необходимо принять два электрона.
Процесс превращения атома кислорода в ион (анион):
$O^0 + 2e^- \rightarrow O^{2-}$
Для образования электронейтрального соединения необходимо, чтобы общее число отданных электронов равнялось общему числу принятых. Так как один атом кислорода принимает два электрона, а один атом калия отдает только один, то для взаимодействия с одним атомом кислорода потребуется два атома калия. Каждый из двух атомов калия отдает по одному электрону атому кислорода.
Общая схема образования связи в оксиде калия ($K_2O$):
$2K^0 + O^0 \rightarrow 2K^+ + O^{2-} \rightarrow K_2O$
Возникшее электростатическое притяжение между двумя катионами калия $K^+$ и одним анионом кислорода $O^{2-}$ формирует ионную связь в соединении.
Ответ: Два атома калия ($K$) отдают по одному электрону одному атому кислорода ($O$). В результате образуются два катиона калия $K^+$ и один анион кислорода $O^{2-}$, которые притягиваются друг к другу, образуя ионное соединение оксид калия ($K_2O$). Схема: $2K + O \rightarrow 2K^+ + O^{2-}$.
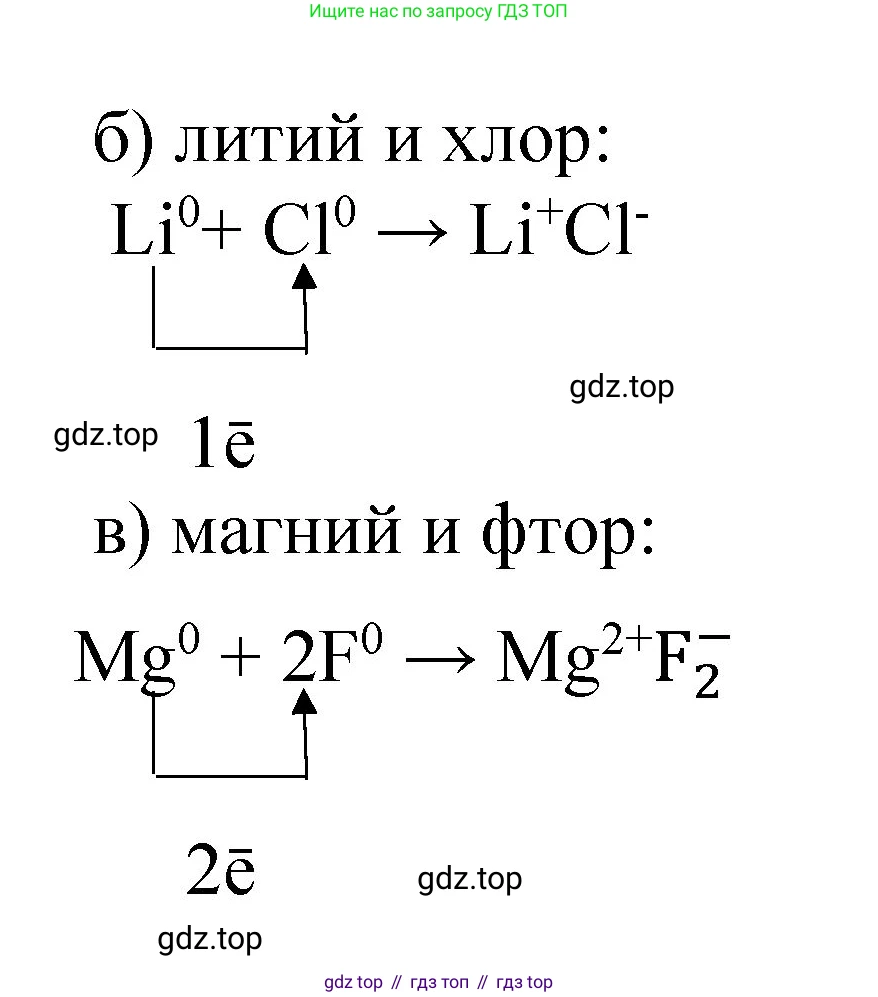
б) лития и хлораРешение
Литий ($Li$) — щелочной металл 1-й группы. Его атом имеет один валентный электрон. Он легко отдает его, превращаясь в положительно заряженный ион $Li^+$, приобретая стабильную электронную конфигурацию гелия.
Схема процесса: $Li^0 - 1e^- \rightarrow Li^+$
Хлор ($Cl$) — неметалл-галоген 17-й группы. Его атому, имеющему семь валентных электронов, для достижения стабильной конфигурации аргона не хватает одного электрона. Он принимает один электрон, превращаясь в отрицательно заряженный хлорид-ион $Cl^-$.
Схема процесса: $Cl^0 + 1e^- \rightarrow Cl^-$
Атом лития отдает один электрон, и атом хлора принимает один электрон. Таким образом, для образования электронейтрального соединения требуется один атом лития и один атом хлора.
Общая схема образования связи в хлориде лития ($LiCl$):
$Li^0 + Cl^0 \rightarrow Li^+ + Cl^- \rightarrow LiCl$
Между катионом лития $Li^+$ и хлорид-анионом $Cl^-$ возникает электростатическое притяжение, то есть ионная связь.
Ответ: Атом лития ($Li$) отдает один валентный электрон атому хлора ($Cl$). В результате образуются катион лития $Li^+$ и хлорид-анион $Cl^-$. Эти ионы образуют ионное соединение хлорид лития ($LiCl$) за счет электростатического притяжения. Схема: $Li + Cl \rightarrow Li^+ + Cl^-$.
в) магния и фтораРешение
Магний ($Mg$) — щелочноземельный металл 2-й группы. Атом магния имеет два валентных электрона. Чтобы достичь стабильной электронной конфигурации неона, он отдает оба электрона, превращаясь в двухзарядный катион $Mg^{2+}$.
Схема процесса: $Mg^0 - 2e^- \rightarrow Mg^{2+}$
Фтор ($F$) — неметалл-галоген 17-й группы, самый электроотрицательный элемент. Атом фтора имеет семь валентных электронов. Для завершения внешнего уровня (до конфигурации неона) ему необходимо принять один электрон, в результате чего он превращается в отрицательно заряженный фторид-ион $F^-$.
Схема процесса: $F^0 + 1e^- \rightarrow F^-$
Атом магния отдает два электрона, а атом фтора может принять только один. Следовательно, для нейтрализации заряда одного иона магния ($+2$) необходимо два иона фтора (каждый с зарядом $-1$). Один атом магния взаимодействует с двумя атомами фтора, отдавая каждому по одному электрону.
Общая схема образования связи во фториде магния ($MgF_2$):
$Mg^0 + 2F^0 \rightarrow Mg^{2+} + 2F^- \rightarrow MgF_2$
Ионная связь в этом соединении возникает за счет притяжения одного катиона магния $Mg^{2+}$ и двух фторид-анионов $F^-$.
Ответ: Атом магния ($Mg$) отдает два своих валентных электрона двум атомам фтора ($F$), по одному электрону каждому. В результате образуется один катион магния $Mg^{2+}$ и два фторид-аниона $F^-$. Между ними возникает электростатическое притяжение, формирующее ионное соединение фторид магния ($MgF_2$). Схема: $Mg + 2F \rightarrow Mg^{2+} + 2F^-$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 66 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 66), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















