Номер 7-25, страница 86 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2026
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 7. Строение вещества. Химические реакции в свете электронной теории. 7.2. Степень окисления - номер 7-25, страница 86.
№7-25 (с. 86)
Условие. №7-25 (с. 86)
скриншот условия

7-25. Определите возможные степени окисления для элементов
а) № 11, 20, 49;
б) № 50, 51, 34, 17.
Ответ обоснуйте.
Решение. №7-25 (с. 86)
Решение 2. №7-25 (с. 86)
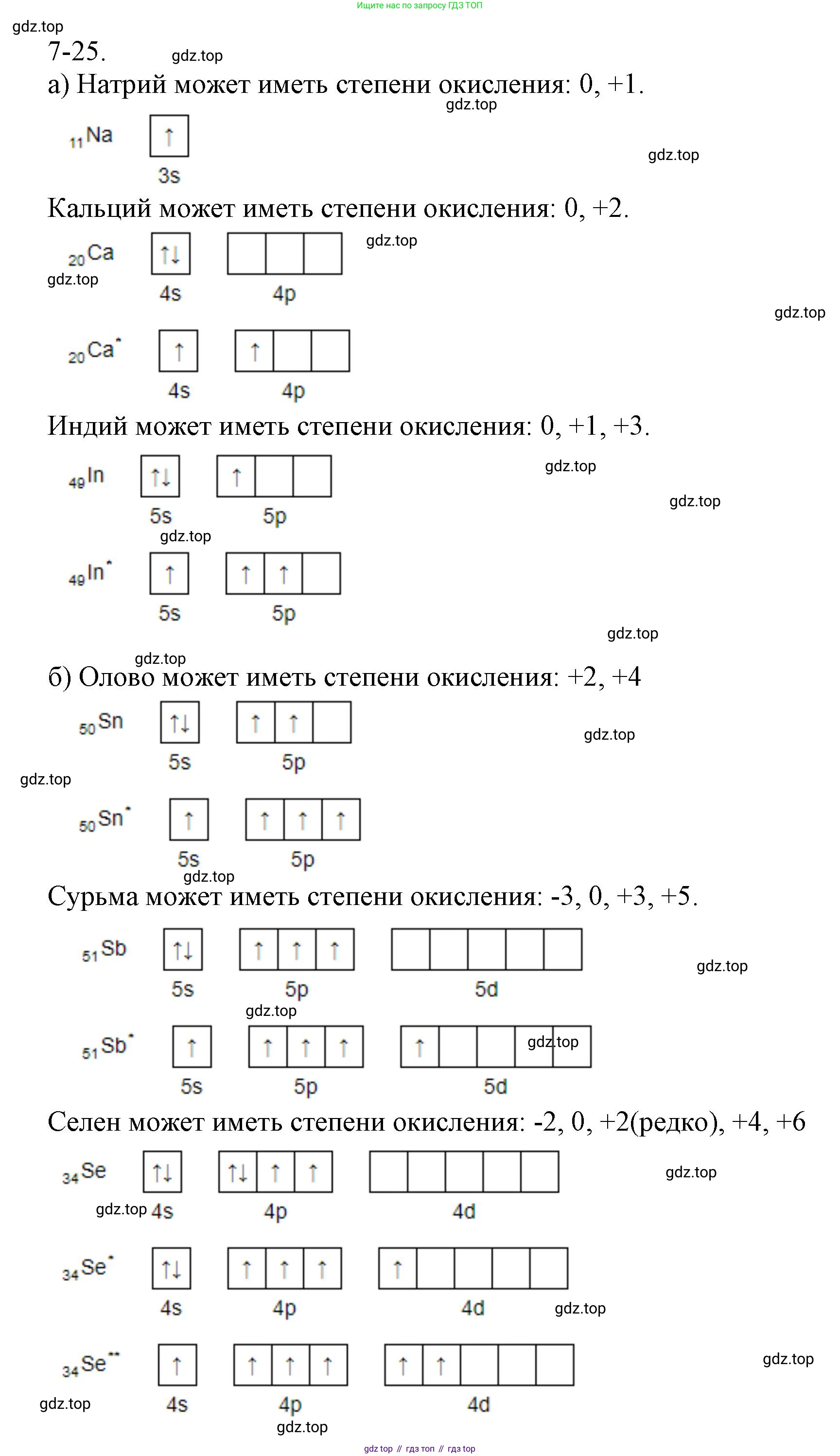
а) Для определения возможных степеней окисления элемента необходимо знать его положение в Периодической системе и строение его атома, в частности, электронную конфигурацию внешнего энергетического уровня.
Элемент с порядковым номером 11 — это натрий (Na). Его электронная конфигурация [Ne]$3s^1$. Он является щелочным металлом (1-я группа, главная подгруппа) и для достижения стабильной электронной конфигурации благородного газа (неона) легко отдает один валентный электрон. Поэтому его единственная и постоянная степень окисления в соединениях — +1. В виде простого вещества степень окисления равна 0.
Элемент № 20 — это кальций (Ca). Его электронная конфигурация [Ar]$4s^2$. Это щелочноземельный металл (2-я группа, главная подгруппа), который для достижения стабильной конфигурации аргона отдает два валентных электрона. Его постоянная степень окисления в соединениях — +2. В виде простого вещества степень окисления равна 0.
Элемент № 49 — это индий (In). Его электронная конфигурация валентных электронов $5s^25p^1$. Он находится в 13-й группе (IIIА подгруппа). Индий может отдавать все три валентных электрона, проявляя высшую степень окисления +3, что соответствует номеру группы. Также из-за "эффекта инертной пары" (энергетической устойчивости электронной пары на s-подуровне) он может отдавать только один p-электрон, проявляя степень окисления +1. Степень окисления 0 характерна для простого вещества.
Ответ: для элемента № 11 возможные степени окисления: 0, +1; для элемента № 20: 0, +2; для элемента № 49: 0, +1, +3.
б) Элемент № 50 — это олово (Sn). Электронная конфигурация валентных электронов $5s^25p^2$ (14-я группа, IVА подгруппа). Олово может отдавать два p-электрона (проявляя степень окисления +2) или все четыре валентных электрона (проявляя высшую степень окисления +4). Обе степени окисления являются распространенными для олова. Степень окисления 0 характерна для простого вещества. В соединениях с активными металлами (станнидах, например $Mg_2Sn$) может проявлять отрицательную степень окисления -4.
Элемент № 51 — это сурьма (Sb). Электронная конфигурация валентных электронов $5s^25p^3$ (15-я группа, VА подгруппа). Сурьма может проявлять положительные степени окисления +3 (при потере трех p-электронов) и высшую +5 (при потере всех пяти валентных электронов). Как металлоид, она также способна принимать 3 электрона до завершения октета, проявляя низшую отрицательную степень окисления -3 (в соединениях с металлами — антимонидах). Степень окисления 0 характерна для простого вещества.
Элемент № 34 — это селен (Se). Электронная конфигурация валентных электронов $4s^24p^4$ (16-я группа, VIА подгруппа). Как неметалл, селен стремится принять 2 электрона для завершения внешнего уровня до октета, проявляя низшую степень окисления -2. В соединениях с более электроотрицательными элементами (кислородом, фтором) он отдает электроны, проявляя положительные степени окисления +4 и высшую +6. Степень окисления 0 характерна для простого вещества.
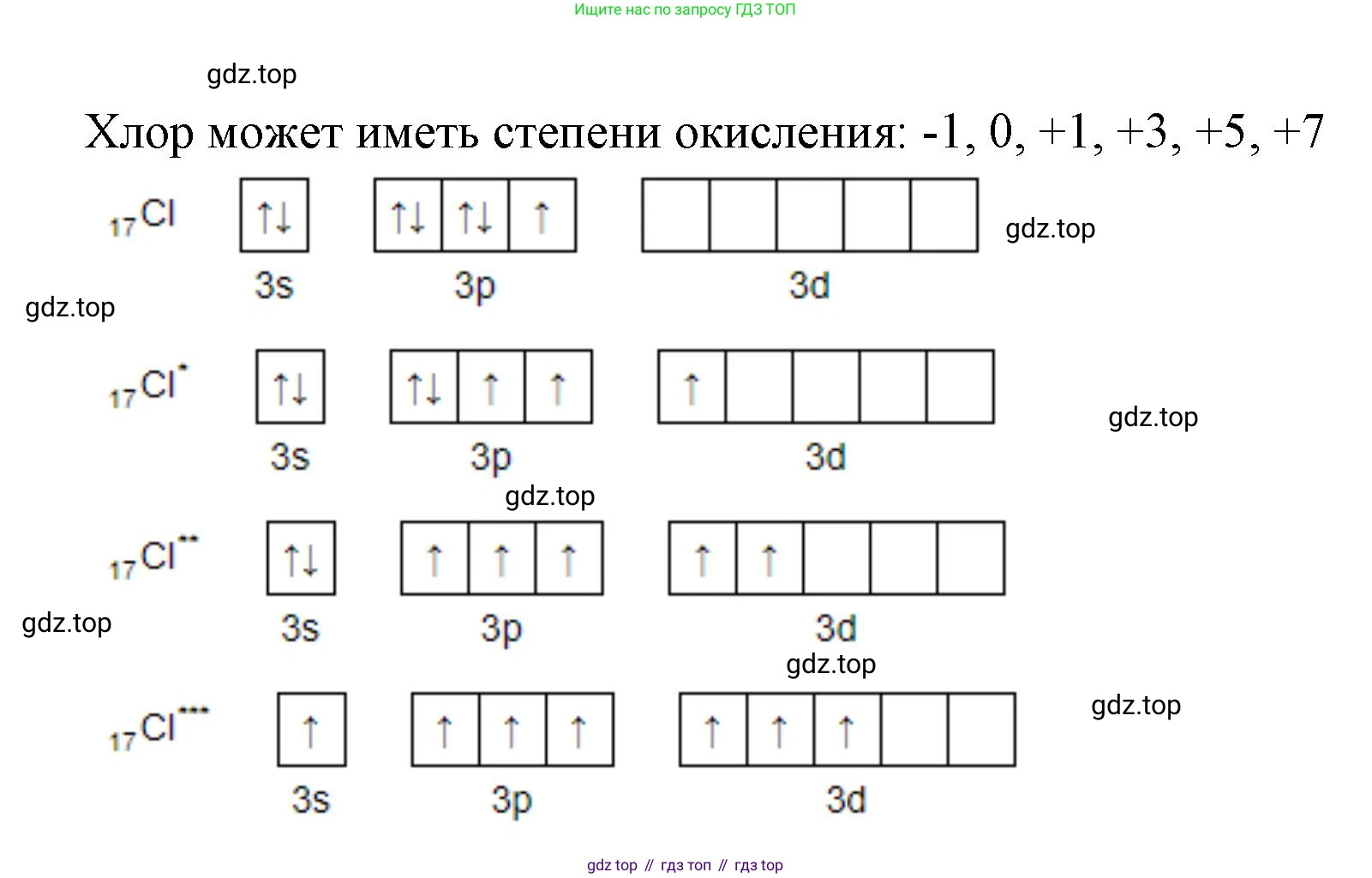
Элемент № 17 — это хлор (Cl). Электронная конфигурация валентных электронов $3s^23p^5$ (17-я группа, VIIА подгруппа). Как типичный галоген с высокой электроотрицательностью, он чаще всего принимает один электрон, проявляя степень окисления -1. В соединениях с более электроотрицательными кислородом и фтором хлор проявляет ряд положительных степеней окисления: +1, +3, +5, +7. Степень окисления 0 характерна для простого вещества $Cl_2$.
Ответ: для элемента № 50: 0, +2, +4 (редко -4); для элемента № 51: -3, 0, +3, +5; для элемента № 34: -2, 0, +4, +6; для элемента № 17: -1, 0, +1, +3, +5, +7.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 7-25 расположенного на странице 86 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7-25 (с. 86), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















