Номер 2, страница 75 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 2. Кислород. Горение. Параграф 22. Кислород, его общая характеристика, нахождение в природе и получение. Подумай, ответь, выполни... - номер 2, страница 75.
№2 (с. 75)
Условие. №2 (с. 75)
скриншот условия

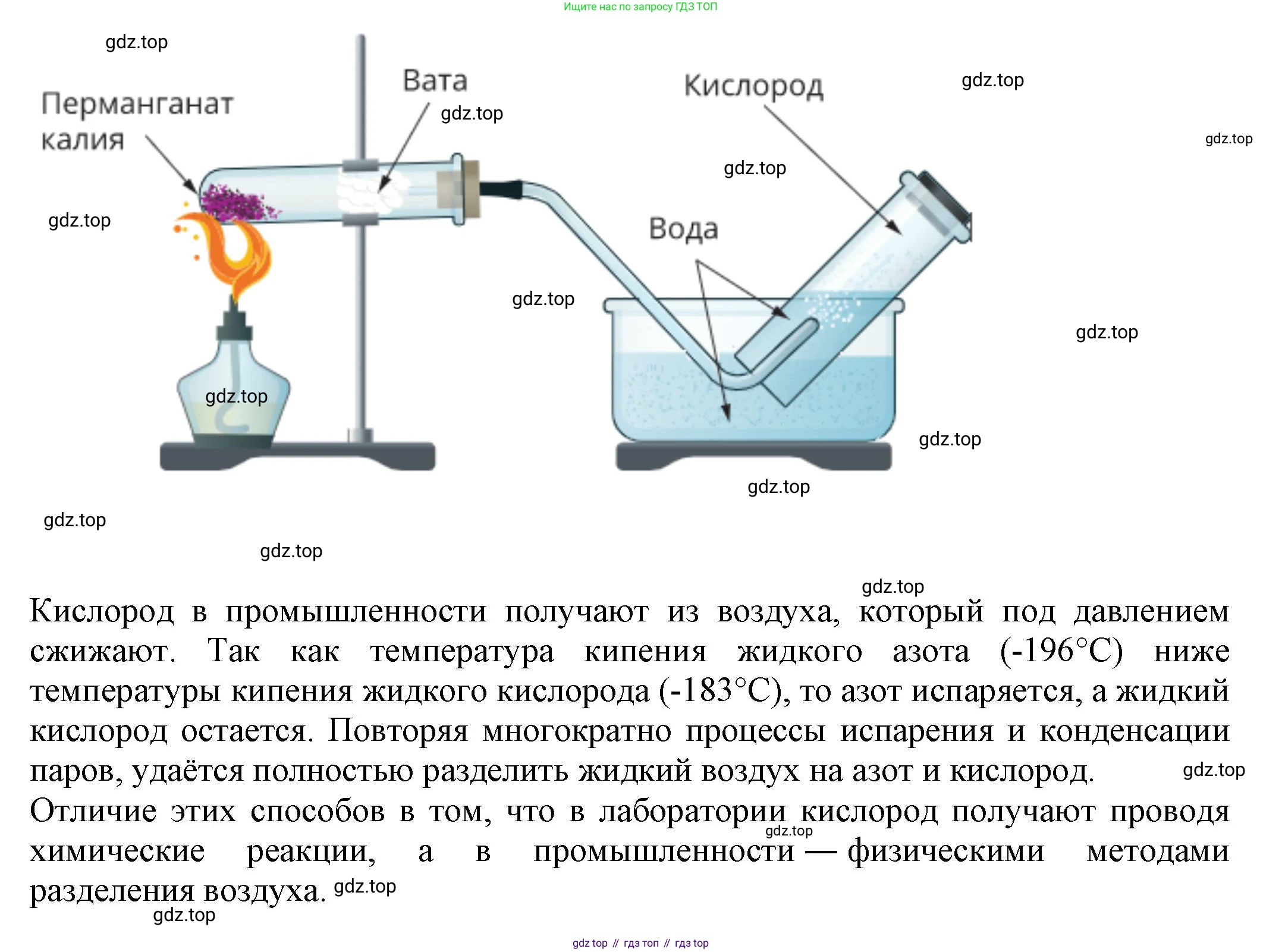
2. Как получают кислород в лаборатории и в промышленности? Напишите уравнения соответствующих реакций. Обсудите с соседом по парте, чем различаются эти способы.
Решение. №2 (с. 75)

Решение 2. №2 (с. 75)
Решение
Получение кислорода в лаборатории
В лабораторных условиях кислород получают в небольших количествах путем химического разложения некоторых кислородсодержащих веществ. Наиболее распространенные способы:
1. Разложение пероксида водорода ($H_2O_2$) в присутствии катализатора, например, оксида марганца(IV) ($MnO_2$). Реакция протекает при комнатной температуре.
Уравнение реакции: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow$
2. Термическое разложение перманганата калия ($KMnO_4$), известного в быту как марганцовка. При нагревании этого вещества выделяется кислород.
Уравнение реакции: $2KMnO_4 \xrightarrow{t} K_2MnO_4 + MnO_2 + O_2\uparrow$
3. Термическое разложение хлората калия ($KClO_3$) (бертолетовой соли), обычно с использованием катализатора ($MnO_2$) для снижения температуры разложения.
Уравнение реакции: $2KClO_3 \xrightarrow{t, \ MnO_2} 2KCl + 3O_2\uparrow$
Ответ: В лаборатории кислород получают разложением пероксида водорода, перманганата калия или хлората калия. Уравнения реакций: $2H_2O_2 \xrightarrow{MnO_2} 2H_2O + O_2\uparrow$; $2KMnO_4 \xrightarrow{t} K_2MnO_4 + MnO_2 + O_2\uparrow$; $2KClO_3 \xrightarrow{t, \ MnO_2} 2KCl + 3O_2\uparrow$.
Получение кислорода в промышленности
В промышленности кислород производят в огромных объемах, используя дешевое и доступное сырье.
1. Основной промышленный способ — ректификация (фракционная перегонка) сжиженного воздуха. Воздух охлаждают до очень низких температур (около $-200^\circ C$) и сжижают. Затем жидкий воздух медленно нагревают. Азот, имеющий более низкую температуру кипения ($-196^\circ C$), испаряется первым, а жидкий кислород (температура кипения $-183^\circ C$) остается. Этот процесс является физическим, а не химическим.
2. Электролиз воды. Через воду, в которую для повышения электропроводности добавлена щелочь или кислота, пропускают электрический ток. Вода разлагается на водород и кислород.
Уравнение реакции: $2H_2O \xrightarrow{электрический \ ток} 2H_2\uparrow + O_2\uparrow$
Этот способ более энергозатратен, поэтому используется реже, в основном там, где требуется кислород высокой чистоты или где есть избыток дешевой электроэнергии.
Ответ: В промышленности кислород получают главным образом путем сжижения и последующей ректификации воздуха (физический способ), а также электролизом воды (химический способ). Уравнение реакции электролиза: $2H_2O \xrightarrow{электрический \ ток} 2H_2\uparrow + O_2\uparrow$.
Различия между лабораторными и промышленными способами
Лабораторные и промышленные способы получения кислорода различаются по нескольким ключевым параметрам:
Масштабы производства: В лаборатории получают граммы или литры кислорода для проведения опытов. В промышленности — тысячи тонн для металлургии, медицины, химического синтеза и других нужд.
Сырье: В лаборатории используют относительно дорогие химические реактивы (перманганат калия, пероксид водорода). В промышленности — самое дешевое и доступное сырье: атмосферный воздух или вода.
Сущность процесса: Лабораторные методы основаны на химических реакциях разложения. Основной промышленный метод (перегонка воздуха) — это физический процесс разделения смеси. Электролиз воды — химический, но требует больших затрат энергии.
Стоимость: Себестоимость кислорода, полученного в лаборатории, очень высока по сравнению с промышленным. Промышленные методы экономически выгодны для производства больших объемов.
Ответ: Лабораторные и промышленные способы различаются масштабами производства (малые/большие), используемым сырьем (дорогие реактивы/дешевый воздух, вода), типом процесса (химическое разложение/физическое разделение) и итоговой стоимостью продукта (высокая/низкая).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 75 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 75), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.














