Номер 3, страница 83 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химическая реакция. Параграф 15. Окисление и восстановление. Вопросы и задания - номер 3, страница 83.
№3 (с. 83)
Условие. №3 (с. 83)
скриншот условия

3. По формулам веществ определите степени окисления: а) водорода; б) кислорода; в) хлора; г) азота; д) серы; е) железа; ж) марганца.
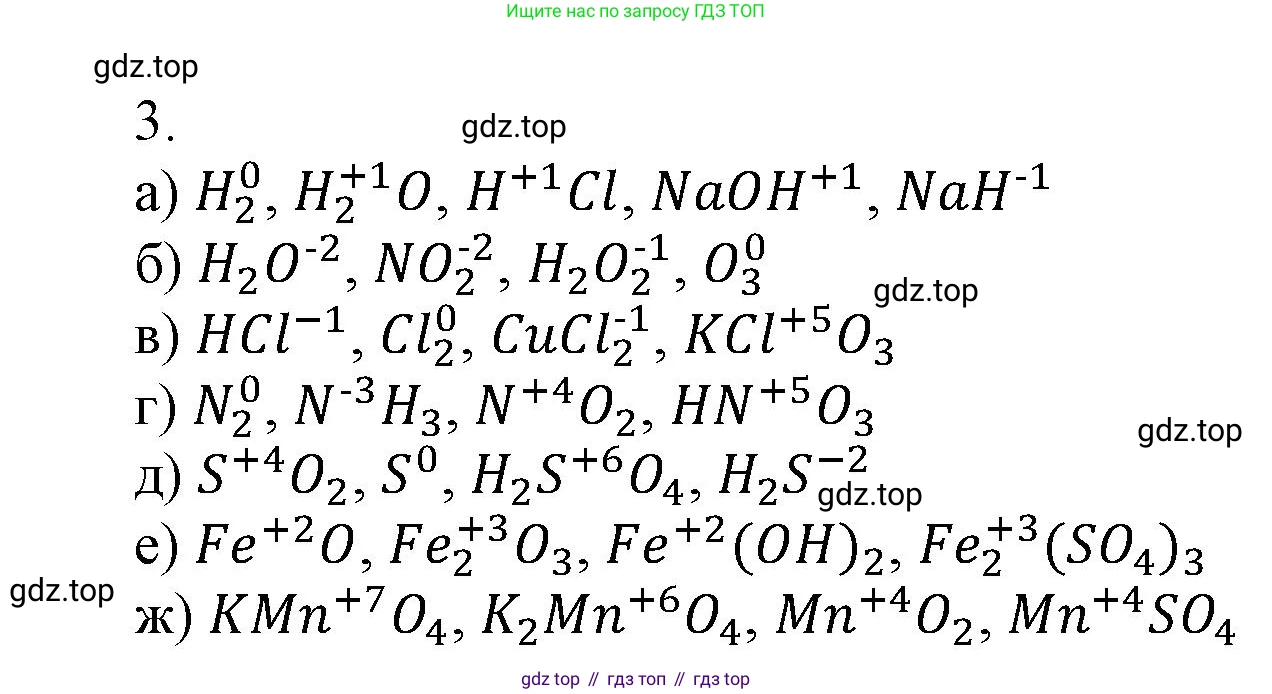
а) $H_2$, $H_2O$, $HCl$, $NaOH$, $NaH$;
б) $H_2O$, $NO_2$, $H_2O_2$, $O_3$;
в) $HCl$, $Cl_2$, $CuCl_2$, $KClO_3$;
г) $N_2$, $NH_3$, $NO_2$, $HNO_3$;
д) $SO_2$, $S$, $H_2SO_4$, $H_2S$;
е) $FeO$, $Fe_2O_3$, $Fe(OH)_2$, $Fe_2(SO_4)_3$;
ж) $KMnO_4$, $K_2MnO_4$, $MnO_2$, $MnSO_4$.
Решение. №3 (с. 83)
Решение 2. №3 (с. 83)
а) водорода Дано: $H_2, H_2O, HCl, NaOH, NaH$.
Найти: Степень окисления водорода (H) в каждом соединении.
Решение:
Для определения степеней окисления будем использовать следующие правила: сумма степеней окисления в нейтральной молекуле равна 0; степень окисления элемента в простом веществе равна 0; степень окисления щелочных металлов (Na) в соединениях равна +1, кислорода (кроме пероксидов и соединений с фтором) равна -2, хлора в соляной кислоте равна -1.
В $H_2$: водород является простым веществом, поэтому его степень окисления равна 0 ($H_2^0$).
В $H_2O$: степень окисления кислорода равна -2. Пусть степень окисления водорода равна $x$. Тогда $2 \cdot x + (-2) = 0$, откуда $x = +1$ ($H_2^{+1}O^{-2}$).
В $HCl$: степень окисления хлора, как более электроотрицательного элемента, равна -1. Пусть степень окисления водорода равна $x$. Тогда $x + (-1) = 0$, откуда $x = +1$ ($H^{+1}Cl^{-1}$).
В $NaOH$: степень окисления натрия +1, кислорода -2. Пусть степень окисления водорода равна $x$. Тогда $(+1) + (-2) + x = 0$, откуда $x = +1$ ($Na^{+1}O^{-2}H^{+1}$).
В $NaH$ (гидрид натрия): водород соединен с активным металлом, поэтому его степень окисления -1. Степень окисления натрия +1. Проверка: $(+1) + (-1) = 0$ ($Na^{+1}H^{-1}$).
Ответ: в $H_2$ – 0, в $H_2O$ – +1, в $HCl$ – +1, в $NaOH$ – +1, в $NaH$ – -1.
б) кислорода Дано: $H_2O, NO_2, H_2O_2, O_3$.
Найти: Степень окисления кислорода (O) в каждом соединении.
Решение:
В $H_2O$: степень окисления водорода равна +1. Пусть степень окисления кислорода равна $x$. Тогда $2 \cdot (+1) + x = 0$, откуда $x = -2$ ($H_2^{+1}O^{-2}$).
В $NO_2$: как правило, в оксидах степень окисления кислорода равна -2. Пусть степень окисления азота $y$. Тогда $y + 2 \cdot (-2) = 0$, откуда $y = +4$. Это возможная степень окисления для азота. Значит, степень окисления кислорода -2 ($N^{+4}O_2^{-2}$).
В $H_2O_2$ (пероксид водорода): это исключение, в пероксидах степень окисления кислорода равна -1. Степень окисления водорода +1. Проверка: $2 \cdot (+1) + 2 \cdot (-1) = 0$ ($H_2^{+1}O_2^{-1}$).
В $O_3$ (озон): это простое вещество (аллотропная модификация кислорода), поэтому степень окисления кислорода равна 0 ($O_3^0$).
Ответ: в $H_2O$ – -2, в $NO_2$ – -2, в $H_2O_2$ – -1, в $O_3$ – 0.
в) хлора Дано: $HCl, Cl_2, CuCl_2, KClO_3$.
Найти: Степень окисления хлора (Cl) в каждом соединении.
Решение:
В $HCl$: степень окисления водорода +1. Пусть степень окисления хлора равна $x$. Тогда $(+1) + x = 0$, откуда $x = -1$ ($H^{+1}Cl^{-1}$).
В $Cl_2$: это простое вещество, поэтому степень окисления хлора равна 0 ($Cl_2^0$).
В $CuCl_2$ (хлорид меди(II)): в бинарных солях галогены с менее электроотрицательными элементами имеют степень окисления -1. Пусть степень окисления меди $y$. Тогда $y + 2 \cdot (-1) = 0$, откуда $y = +2$. Это характерная степень окисления для меди, значит, у хлора -1 ($Cu^{+2}Cl_2^{-1}$).
В $KClO_3$ (хлорат калия): степень окисления калия (щелочной металл) +1, кислорода -2. Пусть степень окисления хлора равна $x$. Тогда $(+1) + x + 3 \cdot (-2) = 0$, откуда $1 + x - 6 = 0$, $x = +5$ ($K^{+1}Cl^{+5}O_3^{-2}$).
Ответ: в $HCl$ – -1, в $Cl_2$ – 0, в $CuCl_2$ – -1, в $KClO_3$ – +5.
г) азота Дано: $N_2, NH_3, NO_2, HNO_3$.
Найти: Степень окисления азота (N) в каждом соединении.
Решение:
В $N_2$: это простое вещество, поэтому степень окисления азота равна 0 ($N_2^0$).
В $NH_3$ (аммиак): степень окисления водорода в соединениях с неметаллами +1. Пусть степень окисления азота равна $x$. Тогда $x + 3 \cdot (+1) = 0$, откуда $x = -3$ ($N^{-3}H_3^{+1}$).
В $NO_2$ (оксид азота(IV)): степень окисления кислорода -2. Пусть степень окисления азота равна $x$. Тогда $x + 2 \cdot (-2) = 0$, откуда $x = +4$ ($N^{+4}O_2^{-2}$).
В $HNO_3$ (азотная кислота): степень окисления водорода +1, кислорода -2. Пусть степень окисления азота равна $x$. Тогда $(+1) + x + 3 \cdot (-2) = 0$, откуда $1 + x - 6 = 0$, $x = +5$ ($H^{+1}N^{+5}O_3^{-2}$).
Ответ: в $N_2$ – 0, в $NH_3$ – -3, в $NO_2$ – +4, в $HNO_3$ – +5.
д) серы Дано: $SO_2, S, H_2SO_4, H_2S$.
Найти: Степень окисления серы (S) в каждом соединении.
Решение:
В $SO_2$ (оксид серы(IV)): степень окисления кислорода -2. Пусть степень окисления серы равна $x$. Тогда $x + 2 \cdot (-2) = 0$, откуда $x = +4$ ($S^{+4}O_2^{-2}$).
В $S$: это простое вещество, поэтому степень окисления серы равна 0 ($S^0$).
В $H_2SO_4$ (серная кислота): степень окисления водорода +1, кислорода -2. Пусть степень окисления серы равна $x$. Тогда $2 \cdot (+1) + x + 4 \cdot (-2) = 0$, откуда $2 + x - 8 = 0$, $x = +6$ ($H_2^{+1}S^{+6}O_4^{-2}$).
В $H_2S$ (сероводород): степень окисления водорода +1. Пусть степень окисления серы равна $x$. Тогда $2 \cdot (+1) + x = 0$, откуда $x = -2$ ($H_2^{+1}S^{-2}$).
Ответ: в $SO_2$ – +4, в $S$ – 0, в $H_2SO_4$ – +6, в $H_2S$ – -2.
е) железа Дано: $FeO, Fe_2O_3, Fe(OH)_2, Fe_2(SO_4)_3$.
Найти: Степень окисления железа (Fe) в каждом соединении.
Решение:
В $FeO$ (оксид железа(II)): степень окисления кислорода -2. Пусть степень окисления железа равна $x$. Тогда $x + (-2) = 0$, откуда $x = +2$ ($Fe^{+2}O^{-2}$).
В $Fe_2O_3$ (оксид железа(III)): степень окисления кислорода -2. Пусть степень окисления железа равна $x$. Тогда $2x + 3 \cdot (-2) = 0$, откуда $2x = 6$, $x = +3$ ($Fe_2^{+3}O_3^{-2}$).
В $Fe(OH)_2$ (гидроксид железа(II)): гидроксид-ион ($OH^−$) имеет суммарный заряд -1. Пусть степень окисления железа равна $x$. Тогда $x + 2 \cdot (-1) = 0$, откуда $x = +2$ ($Fe^{+2}(OH)_2^{-1}$).
В $Fe_2(SO_4)_3$ (сульфат железа(III)): сульфат-ион ($SO_4^{2−}$) имеет суммарный заряд -2. Пусть степень окисления железа равна $x$. Тогда $2x + 3 \cdot (-2) = 0$, откуда $2x = 6$, $x = +3$ ($Fe_2^{+3}(SO_4)_3^{-2}$).
Ответ: в $FeO$ – +2, в $Fe_2O_3$ – +3, в $Fe(OH)_2$ – +2, в $Fe_2(SO_4)_3$ – +3.
ж) марганца Дано: $KMnO_4, K_2MnO_4, MnO_2, MnSO_4$.
Найти: Степень окисления марганца (Mn) в каждом соединении.
Решение:
В $KMnO_4$ (перманганат калия): степень окисления калия +1, кислорода -2. Пусть степень окисления марганца равна $x$. Тогда $(+1) + x + 4 \cdot (-2) = 0$, откуда $1 + x - 8 = 0$, $x = +7$ ($K^{+1}Mn^{+7}O_4^{-2}$).
В $K_2MnO_4$ (манганат калия): степень окисления калия +1, кислорода -2. Пусть степень окисления марганца равна $x$. Тогда $2 \cdot (+1) + x + 4 \cdot (-2) = 0$, откуда $2 + x - 8 = 0$, $x = +6$ ($K_2^{+1}Mn^{+6}O_4^{-2}$).
В $MnO_2$ (оксид марганца(IV)): степень окисления кислорода -2. Пусть степень окисления марганца равна $x$. Тогда $x + 2 \cdot (-2) = 0$, откуда $x = +4$ ($Mn^{+4}O_2^{-2}$).
В $MnSO_4$ (сульфат марганца(II)): сульфат-ион ($SO_4^{2−}$) имеет суммарный заряд -2. Пусть степень окисления марганца равна $x$. Тогда $x + (-2) = 0$, откуда $x = +2$ ($Mn^{+2}SO_4^{-2}$).
Ответ: в $KMnO_4$ – +7, в $K_2MnO_4$ – +6, в $MnO_2$ – +4, в $MnSO_4$ – +2.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 83 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 83), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















