Номер 9, страница 155 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 30. Азотная кислота. Вопросы и задания - номер 9, страница 155.
№9 (с. 155)
Условие. №9 (с. 155)
скриншот условия

9. Сульфат аммония наряду с аммиачной селитрой является важным азотным удобрением. Предложите метод его получения из азота.
Решение. №9 (с. 155)
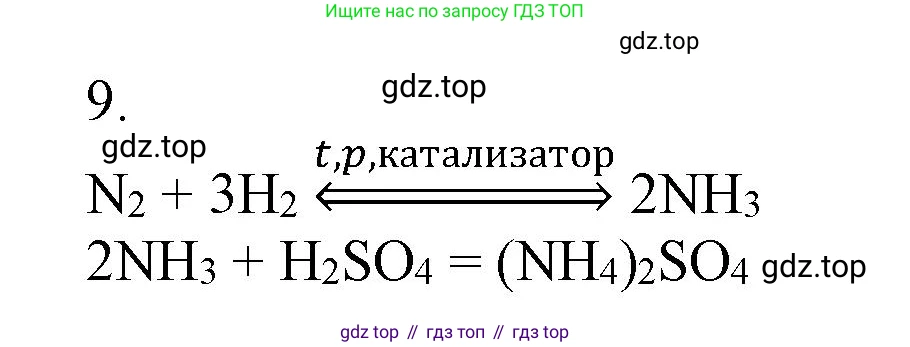
Решение 2. №9 (с. 155)
Дано:
Исходное вещество для получения азотной составляющей удобрения - азот ($N_2$).
Найти:
Метод получения сульфата аммония ($(NH_4)_2SO_4$).
Решение:
Для получения сульфата аммония ($(NH_4)_2SO_4$) необходимы аммиак ($NH_3$) и серная кислота ($H_2SO_4$). Процесс получения целевого продукта из азота можно представить в виде последовательности химических превращений.
1. Получение аммиака ($NH_3$) из азота
Аммиак в промышленности получают каталитическим синтезом из азота и водорода. Этот процесс известен как процесс Габера-Боша. Азот берут из воздуха, а водород получают, например, паровой конверсией метана.
Реакция синтеза аммиака является обратимой и экзотермической. Для смещения химического равновесия в сторону образования продукта, согласно принципу Ле Шателье, процесс ведут при высоком давлении, повышенной температуре и в присутствии катализатора (пористое железо).
Уравнение реакции:
$N_2(г) + 3H_2(г) \rightleftharpoons 2NH_3(г)$
Промышленные условия: температура 400–500 °C, давление 15–35 МПа, катализатор.
2. Получение серной кислоты ($H_2SO_4$)
Серную кислоту получают так называемым контактным способом. Исходным сырьем для ее производства служит сера ($S$) или сульфид железа(II) (пирит $FeS_2$). Рассмотрим получение из серы.
Стадия а: Получение оксида серы(IV) ($SO_2$).
Серу сжигают в печах в токе осушенного воздуха (кислорода):
$S + O_2 \xrightarrow{t} SO_2$
Стадия б: Каталитическое окисление $SO_2$ до $SO_3$.
Это ключевая, лимитирующая стадия всего процесса. Оксид серы(IV) окисляют кислородом воздуха на катализаторе при повышенной температуре. Реакция обратимая и экзотермическая.
$2SO_2 + O_2 \rightleftharpoons 2SO_3$
Условия: температура 450-500 °C, катализатор – оксид ванадия(V) ($V_2O_5$).
Стадия в: Получение серной кислоты.
Оксид серы(VI) ($SO_3$) поглощают не водой, а концентрированной серной кислотой (98%) с образованием олеума ($H_2S_2O_7$). Это делается для предотвращения образования тумана серной кислоты, который возникает при прямой реакции $SO_3$ с водой. Затем олеум разбавляют водой до получения серной кислоты нужной концентрации.
$SO_3 + H_2SO_4 (конц.) \rightarrow H_2S_2O_7$
$H_2S_2O_7 + H_2O \rightarrow 2H_2SO_4$
3. Получение сульфата аммония ($(NH_4)_2SO_4$)
На заключительном этапе проводят реакцию нейтрализации между полученными на предыдущих стадиях аммиаком (который проявляет основные свойства) и серной кислотой.
Для этого газообразный аммиак пропускают через раствор серной кислоты:
$2NH_3 + H_2SO_4 \rightarrow (NH_4)_2SO_4$
В результате реакции образуется раствор соли, из которого затем выпариванием воды выделяют кристаллический сульфат аммония.
Ответ:
Метод получения сульфата аммония из азота представляет собой многостадийный синтез:
1. Получение аммиака синтезом из азота и водорода (процесс Габера-Боша): $N_2 + 3H_2 \rightleftharpoons 2NH_3$.
2. Получение серной кислоты контактным способом, включающим сжигание серы до $SO_2$, каталитическое окисление $SO_2$ до $SO_3$ и последующее получение кислоты из $SO_3$.
3. Реакция нейтрализации полученного аммиака серной кислотой: $2NH_3 + H_2SO_4 \rightarrow (NH_4)_2SO_4$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 9 расположенного на странице 155 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №9 (с. 155), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















