Номер 4, страница 169 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 3. Неметаллы. Параграф 34. Уголь. Вопросы и задания - номер 4, страница 169.
№4 (с. 169)
Условие. №4 (с. 169)
скриншот условия

4. Сажа, наряду с водородом, образуется при пиролизе метана $CH_4$ — нагревании его без доступа воздуха. Напишите уравнение реакции. Рассчитайте массу сажи, образующейся при пиролизе $56 \text{ м}^3$ метана, если выход продукта реакции составляет $95\%$.
Решение. №4 (с. 169)
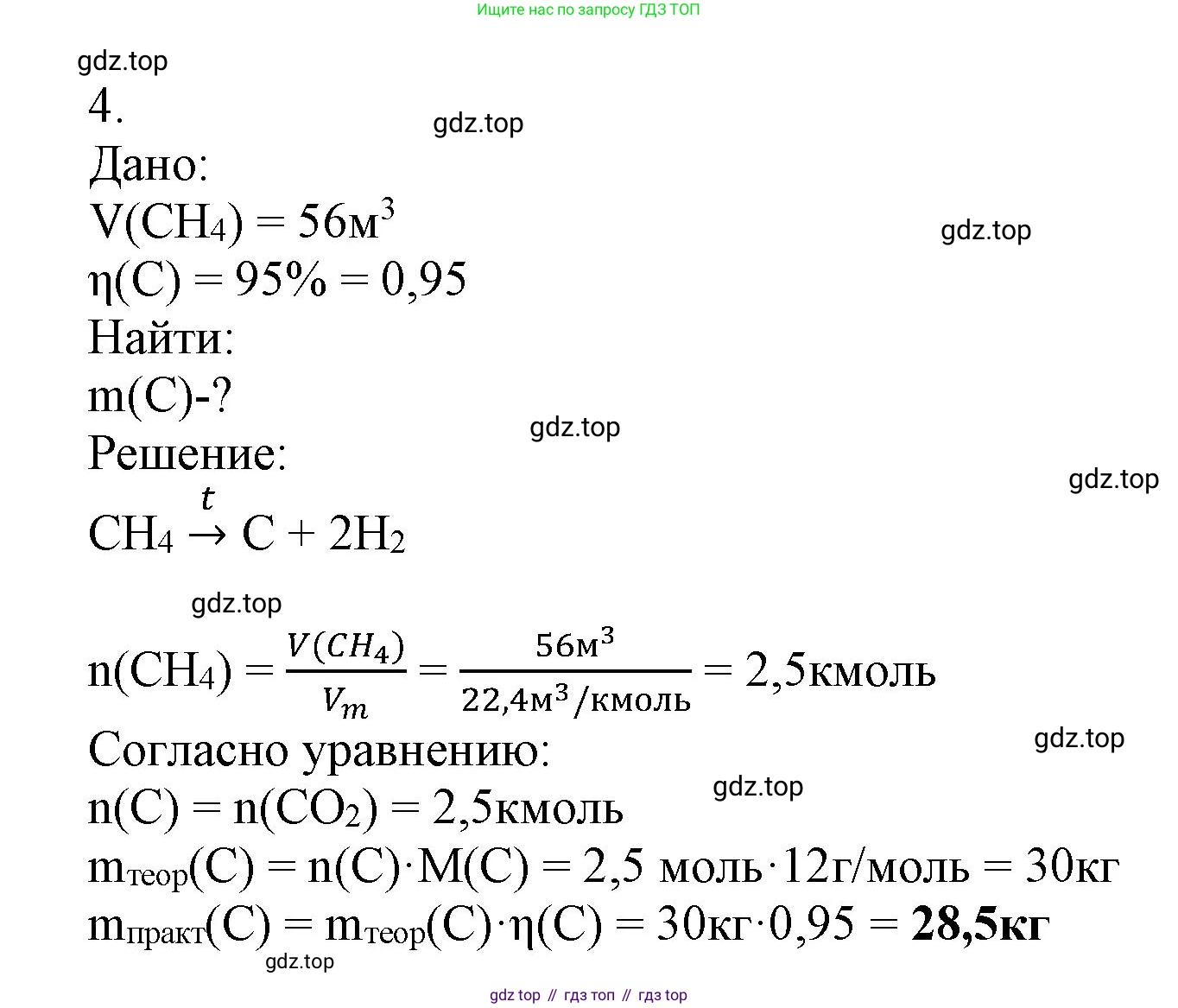
Решение 2. №4 (с. 169)
Напишите уравнение реакции.
Пиролиз метана (нагревание без доступа воздуха) приводит к его разложению на простые вещества: углерод (сажу) и водород. Уравнение реакции выглядит следующим образом:
$CH_4 \xrightarrow{t} C + 2H_2$
Ответ: $CH_4 \xrightarrow{t} C + 2H_2$
Рассчитайте массу сажи, образующейся при пиролизе 56 м³ метана, если выход продукта реакции составляет 95%. Дано:
$V(CH_4) = 56 \text{ м³}$
$\eta(\text{C}) = 95\%$
Перевод в систему СИ не требуется, так как объем уже дан в м³. Молярный объем при нормальных условиях (н.у.) составляет $V_m = 22.4 \cdot 10^{-3} \text{ м³/моль}$.
Найти:
$m_{практ}(\text{C}) - ?$
Решение:
1. Найдем количество вещества (моль) метана, вступившего в реакцию. Расчет ведем, принимая условия нормальными (н.у.):
$n(CH_4) = \frac{V(CH_4)}{V_m} = \frac{56 \text{ м³}}{22.4 \cdot 10^{-3} \text{ м³/моль}} = 2500 \text{ моль}$
2. Согласно уравнению реакции $CH_4 \rightarrow C + 2H_2$, из 1 моль метана образуется 1 моль углерода (сажи). Следовательно, соотношение количеств веществ метана и углерода равно 1:1.
$n_{теор}(\text{C}) = n(CH_4) = 2500 \text{ моль}$
3. Рассчитаем теоретическую массу сажи, которая могла бы образоваться при 100% выходе. Молярная масса углерода $M(C) = 12 \text{ г/моль}$.
$m_{теор}(\text{C}) = n_{теор}(\text{C}) \cdot M(\text{C}) = 2500 \text{ моль} \cdot 12 \text{ г/моль} = 30000 \text{ г} = 30 \text{ кг}$
4. Рассчитаем практическую массу сажи с учетом выхода продукта реакции, который составляет 95% (или 0.95 в долях).
$m_{практ}(\text{C}) = m_{теор}(\text{C}) \cdot \eta(\text{C}) = 30 \text{ кг} \cdot 0.95 = 28.5 \text{ кг}$
Ответ: масса образующейся сажи составляет 28.5 кг.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 169 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 169), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















