Номер 6, страница 231 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Обобщение сведений об элементах и неорганических веществах. Параграф 46. Закономерности изменения свойств элементов и простых веществ. Вопросы и задания - номер 6, страница 231.
№6 (с. 231)
Условие. №6 (с. 231)
скриншот условия

6. Постройте схемы, аналогичные схемам 6 и 7, для элементов и простых веществ 3-го периода. Объясните наблюдаемые закономерности.
Решение. №6 (с. 231)

Решение 2. №6 (с. 231)
Постройте схемы, аналогичные схемам 6 и 7, для элементов и простых веществ 3-го периода.
Схема, аналогичная схеме 6 (свойства атомов элементов 3-го периода):
| Элемент | Натрий (Na) | Магний (Mg) | Алюминий (Al) | Кремний (Si) | Фосфор (P) | Сера (S) | Хлор (Cl) | Аргон (Ar) |
| Заряд ядра ($Z$) | +11 | +12 | +13 | +14 | +15 | +16 | +17 | +18 |
| Электронная конфигурация внешнего слоя | $3s^1$ | $3s^2$ | $3s^23p^1$ | $3s^23p^2$ | $3s^23p^3$ | $3s^23p^4$ | $3s^23p^5$ | $3s^23p^6$ |
| Число валентных электронов | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Атомный радиус, пм | 186 | 160 | 143 | 117 | 110 | 104 | 99 | 94 |
| Электроотрицательность (по Полингу) | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 | - |
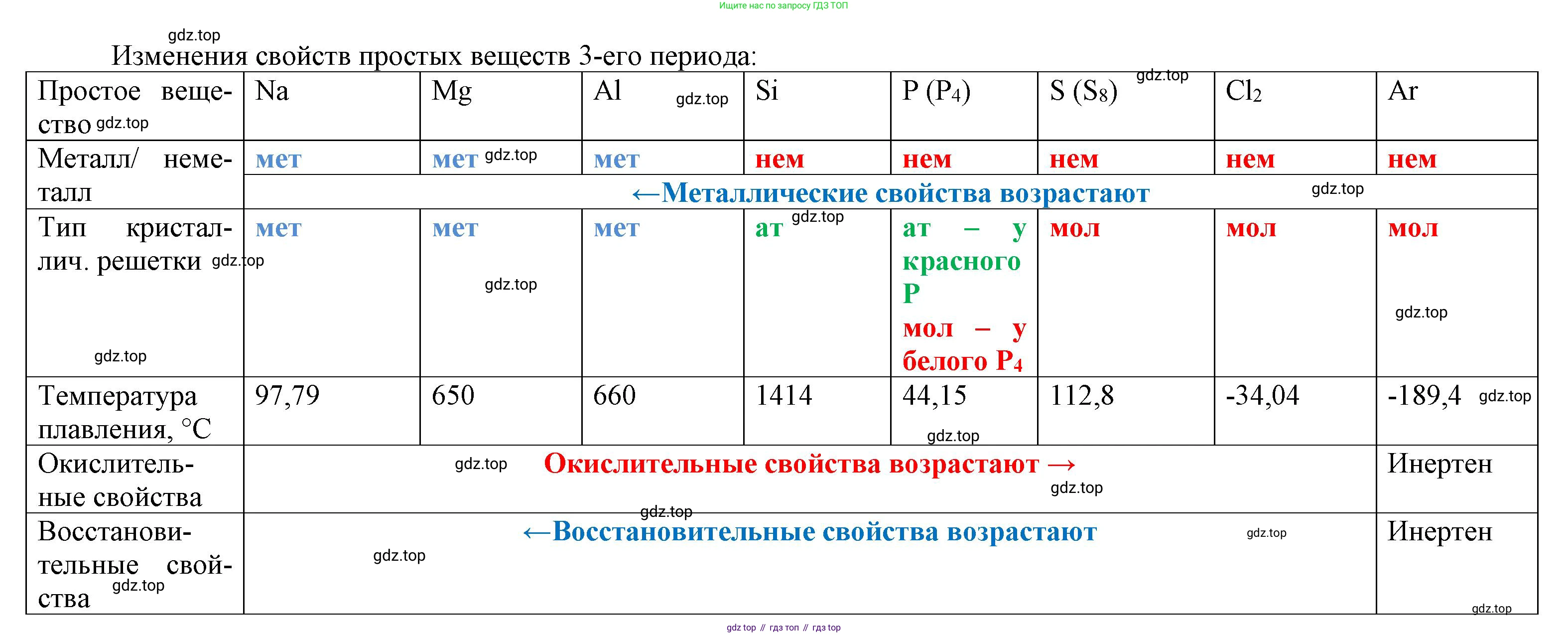
Схема, аналогичная схеме 7 (свойства простых веществ 3-го периода):
| Простое вещество | Натрий (Na) | Магний (Mg) | Алюминий (Al) | Кремний (Si) | Фосфор (P) | Сера (S) | Хлор (Cl) | Аргон (Ar) |
| Тип химической связи | Металлическая | Металлическая | Металлическая | Ковалентная неполярная | Ковалентная неполярная | Ковалентная неполярная | Ковалентная неполярная | - (силы Ван-дер-Ваальса) |
| Тип кристаллической решётки | Металлическая | Металлическая | Металлическая | Атомная | Молекулярная ($P_4$) | Молекулярная ($S_8$) | Молекулярная ($Cl_2$) | Атомная (в тв. состоянии) |
| Характер и свойства | Типичный металл. Мягкий, серебристо-белый, легкоплавкий. | Типичный металл. Легкий, ковкий, серебристо-белый. | Типичный металл. Легкий, ковкий, серебристо-белый. | Неметалл (металлоид). Твердый, хрупкий, полупроводник. | Типичный неметалл. Существует в виде нескольких аллотропных модификаций ($P_4$ - белый). | Типичный неметалл. Хрупкое кристаллическое вещество желтого цвета ($S_8$). | Типичный неметалл, галоген. Газ желто-зеленого цвета ($Cl_2$). | Инертный газ. Бесцветный газ без запаха. |
Объясните наблюдаемые закономерности.
Анализ представленных схем позволяет выявить следующие закономерности изменения свойств при движении слева направо по 3-му периоду:
1. Изменение свойств атомов. С ростом порядкового номера от Na ($Z=11$) до Ar ($Z=18$) увеличивается заряд ядра. Поскольку число электронных слоев остается неизменным (равным трем), притяжение электронов внешнего слоя к ядру усиливается. Это приводит к двум главным последствиям: атомный радиус закономерно уменьшается, а электроотрицательность (способность атома притягивать к себе электроны) возрастает. Также последовательно на единицу увеличивается число валентных электронов (от 1 у Na до 8 у Ar).
2. Изменение строения и свойств простых веществ. Эти изменения в строении атомов напрямую влияют на свойства образуемых ими простых веществ:
- В начале периода (Na, Mg, Al) атомы имеют мало валентных электронов и низкую электроотрицательность, поэтому они легко их отдают. Образуется металлическая химическая связь и металлическая кристаллическая решётка. Вещества проявляют ярко выраженные металлические свойства.
- В середине периода (Si) атому с четырьмя валентными электронами энергетически невыгодно ни отдавать, ни принимать электроны. Вместо этого он образует четыре прочные ковалентные связи с соседними атомами, формируя гигантскую атомную кристаллическую решётку. Это обуславливает большую твердость и тугоплавкость кремния.
- Во второй половине периода (P, S, Cl) атомы имеют высокую электроотрицательность и стремятся завершить свой внешний электронный слой, образуя ковалентные связи. При этом формируются отдельные молекулы ($P_4$, $S_8$, $Cl_2$). Внутримолекулярные связи прочные, но между молекулами действуют слабые межмолекулярные силы. Поэтому эти вещества имеют молекулярные кристаллические решётки, низкие температуры плавления и являются типичными неметаллами.
- В конце периода (Ar) атом имеет завершенный внешний слой. Он химически инертен, поэтому простое вещество состоит из отдельных атомов, связанных в твердом состоянии лишь очень слабыми силами Ван-дер-Ваальса.
3. Общая тенденция. Таким образом, по мере движения по периоду слева направо происходит ослабление металлических свойств и усиление неметаллических. Происходит переход от простых веществ с металлической решёткой (металлы) к веществам с атомной и далее с молекулярной решёткой (неметаллы).
Ответ: Схемы, представленные в виде таблиц, и их анализ показывают, что в 3-м периоде с ростом заряда ядра атомов закономерно уменьшается их радиус и возрастает электроотрицательность. Это приводит к смене типа химической связи и кристаллической решётки в простых веществах: от металлической (Na, Mg, Al) через атомную (Si) к молекулярной (P, S, Cl). Как следствие, наблюдается переход от типичных металлов к типичным неметаллам.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 231 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 231), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















