Номер 5, страница 234 - гдз по химии 9 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2022 - 2026
Цвет обложки: белый с молекулами
ISBN: 978-5-358-15523-7
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 5. Обобщение сведений об элементах и неорганических веществах. Параграф 47. Закономерности изменения свойств соединений элементов. Вопросы и задания - номер 5, страница 234.
№5 (с. 234)
Условие. №5 (с. 234)
скриншот условия

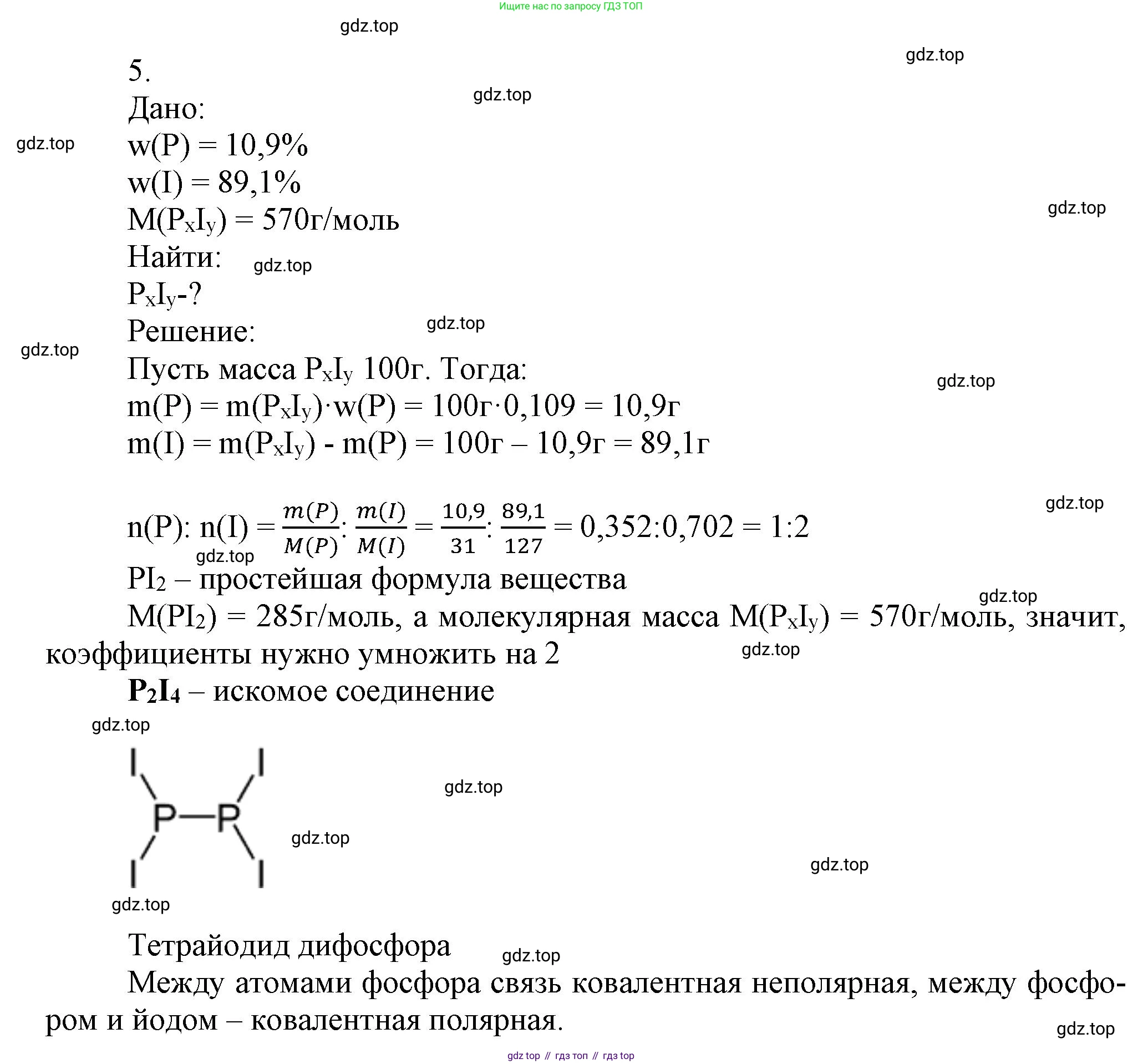
5. Препарат, который вы видите на фотографии (рис. 123), был синтезирован в Московском университете в 1867 г. Запишите истинную и простейшую формулу соединения, если известно, что оно содержит 10,9% фосфора и 89,1% иода по массе, а его молярная масса равна 570 г/моль. Назовите вещество, определите тип связи в молекуле. Изобразите структурную формулу соединения, зная, что все связи в нём одинарные.
Рис. 123. Препарат, полученный в Московском университете
Рис. 124. Нитевидные кристаллы никеля, полученные в МГУ в 2008 г.
Решение. №5 (с. 234)
Решение 2. №5 (с. 234)
Дано:
Массовая доля фосфора $\omega(P) = 10,9\% = 0,109$
Массовая доля иода $\omega(I) = 89,1\% = 0,891$
Молярная масса соединения $M(P_xI_y) = 570 \text{ г/моль}$
Найти:
Простейшую и истинную формулы, название вещества, тип связи в молекуле, структурную формулу соединения.
Решение:
Запишите истинную и простейшую формулу соединения
1. Сначала определим простейшую (эмпирическую) формулу вещества. Для этого найдем соотношение количеств вещества (молей) фосфора и иода. Допустим, у нас есть 100 г соединения, тогда масса фосфора и иода в нём будет:
$m(P) = 100 \text{ г} \cdot 0,109 = 10,9 \text{ г}$
$m(I) = 100 \text{ г} \cdot 0,891 = 89,1 \text{ г}$
Используя молярные массы элементов ($A_r(P) \approx 31 \text{ г/моль}$, $A_r(I) \approx 127 \text{ г/моль}$), вычислим количество вещества каждого элемента:
$n(P) = \frac{m(P)}{A_r(P)} = \frac{10,9 \text{ г}}{31 \text{ г/моль}} \approx 0,352 \text{ моль}$
$n(I) = \frac{m(I)}{A_r(I)} = \frac{89,1 \text{ г}}{127 \text{ г/моль}} \approx 0,702 \text{ моль}$
Найдем соотношение атомов в формуле, разделив полученные количества вещества на наименьшее из них (0,352 моль):
$x : y = n(P) : n(I) = 0,352 : 0,702 \approx \frac{0,352}{0,352} : \frac{0,702}{0,352} \approx 1 : 1,99 \approx 1 : 2$
Таким образом, простейшая формула соединения — $PI_2$.
2. Теперь определим истинную (молекулярную) формулу. Вычислим молярную массу, соответствующую простейшей формуле:
$M(PI_2) = A_r(P) + 2 \cdot A_r(I) = 31 + 2 \cdot 127 = 285 \text{ г/моль}$
Сравним вычисленную молярную массу с истинной молярной массой, данной в условии:
$N = \frac{M(\text{истинная})}{M(PI_2)} = \frac{570 \text{ г/моль}}{285 \text{ г/моль}} = 2$
Коэффициент N показывает, во сколько раз истинная формула "больше" простейшей. Умножим индексы в простейшей формуле на 2: $(PI_2)_2 = P_2I_4$.
Ответ: Простейшая формула — $PI_2$, истинная формула — $P_2I_4$.
Назовите вещество, определите тип связи в молекуле
Вещество с формулой $P_2I_4$ является бинарным соединением, состоящим из двух неметаллов. Его систематическое название — тетраиодид дифосфора.
Связь в молекуле образована атомами неметаллов: фосфора и иода. В молекуле $P_2I_4$ присутствуют два типа ковалентной связи:
1. Связь между двумя одинаковыми атомами фосфора (P–P) является ковалентной неполярной.
2. Связь между атомами фосфора и иода (P–I) является ковалентной полярной, так как электроотрицательности этих элементов различны (ЭО(P) ≈ 2,19, ЭО(I) ≈ 2,66).
Ответ: Название вещества — тетраиодид дифосфора. Тип связи в молекуле — ковалентная (полярная и неполярная).
Изобразите структурную формулу соединения, зная, что все связи в нём одинарные
Исходя из молекулярной формулы $P_2I_4$ и условия, что все связи в молекуле одинарные, наиболее вероятной структурой является та, в которой два атома фосфора соединены между собой, и к каждому атому фосфора присоединено по два атома иода. В такой структуре валентность фосфора равна III, а иода — I, что соответствует их типичным валентностям.
Структурная формула выглядит следующим образом:
I I
| |
I—P—P—I
Ответ: Структурная формула соединения:
I I
| |
I—P—P—I
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 234 к учебнику 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 234), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) учебного пособия издательства Просвещение.















