Номер 13, страница 45 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства кислот как электролитов. Вариант 4 - номер 13, страница 45.
№13 (с. 45)
Условие. №13 (с. 45)
скриншот условия

13. Напишите молекулярные и ионные уравнения, с помощью которых можно осуществить следующие превращения:
$CuO \rightarrow CuSO_4 \rightarrow Cu(OH)_2$
Решение. №13 (с. 45)
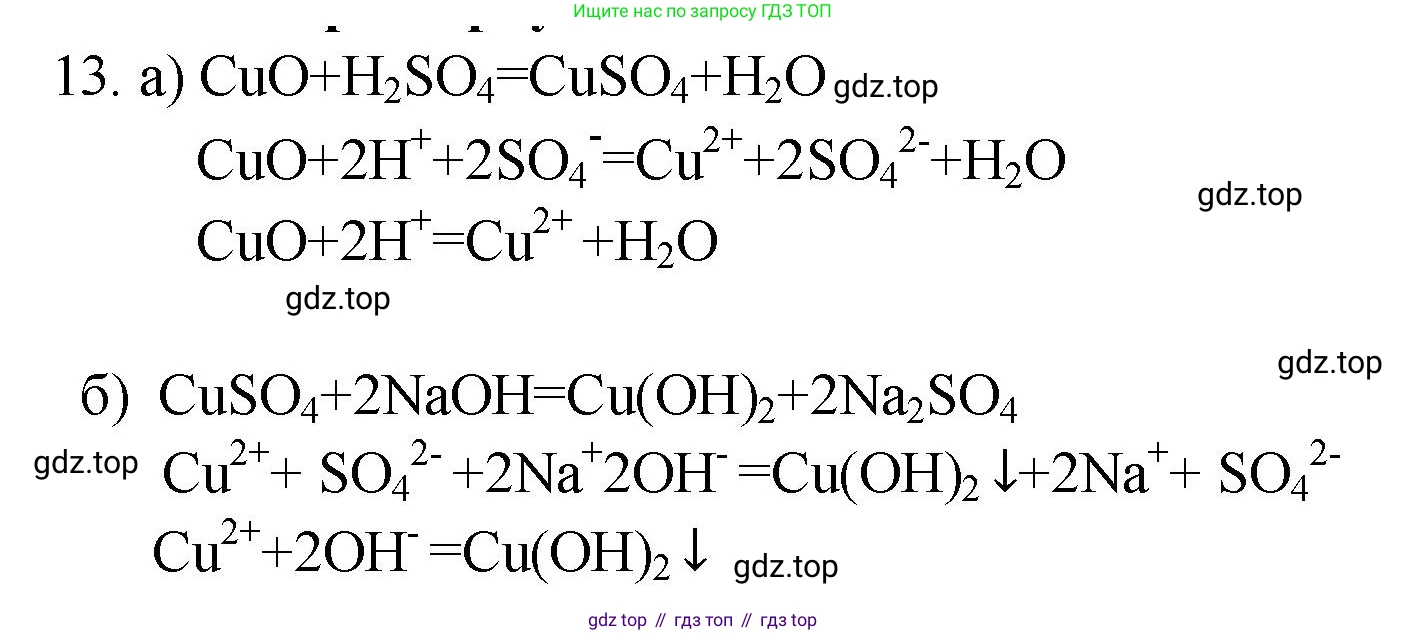
Решение 2. №13 (с. 45)
CuO → CuSO₄
Первое превращение – это получение сульфата меди(II) из оксида меди(II). Оксид меди(II) ($CuO$) является основным оксидом, поэтому для получения соли он должен прореагировать с кислотой. В данном случае, чтобы получить сульфат ($SO_4$), необходима серная кислота ($H_2SO_4$).
Молекулярное уравнение реакции:
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
Для составления ионных уравнений запишем вещества в ионной форме, если они являются сильными электролитами в растворе. $CuO$ – твёрдое нерастворимое вещество, на ионы не расписывается. $H_2SO_4$ – сильная кислота, диссоциирует на $2H^+$ и $SO_4^{2-}$. $CuSO_4$ – растворимая соль, диссоциирует на $Cu^{2+}$ и $SO_4^{2-}$. $H_2O$ - слабый электролит, на ионы не расписывается.
Полное ионное уравнение:
$CuO + 2H^+ + SO_4^{2-} \rightarrow Cu^{2+} + SO_4^{2-} + H_2O$
Сокращённое ионное уравнение получается после исключения одинаковых ионов (ионов-наблюдателей $SO_4^{2-}$) из обеих частей уравнения:
$CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$
Ответ:
Молекулярное уравнение: $CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$.
Полное ионное уравнение: $CuO + 2H^+ + SO_4^{2-} \rightarrow Cu^{2+} + SO_4^{2-} + H_2O$.
Сокращённое ионное уравнение: $CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$.
CuSO₄ → Cu(OH)₂
Второе превращение – получение гидроксида меди(II) из сульфата меди(II). Гидроксид меди(II) ($Cu(OH)_2$) является нерастворимым основанием. Его можно получить в результате реакции ионного обмена между раствором соли меди и раствором щёлочи, например, гидроксидом натрия ($NaOH$). В результате реакции выпадает осадок $Cu(OH)_2$.
Молекулярное уравнение реакции:
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
Для составления ионных уравнений учтём, что $CuSO_4$, $NaOH$ и $Na_2SO_4$ – растворимые соли и основания (сильные электролиты), а $Cu(OH)_2$ – нерастворимое вещество (осадок), на ионы не расписывается.
Полное ионное уравнение:
$Cu^{2+} + SO_4^{2-} + 2Na^+ + 2OH^- \rightarrow Cu(OH)_2\downarrow + 2Na^+ + SO_4^{2-}$
Сокращённое ионное уравнение получается после исключения ионов-наблюдателей ($Na^+$ и $SO_4^{2-}$):
$Cu^{2+} + 2OH^- \rightarrow Cu(OH)_2\downarrow$
Ответ:
Молекулярное уравнение: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$.
Полное ионное уравнение: $Cu^{2+} + SO_4^{2-} + 2Na^+ + 2OH^- \rightarrow Cu(OH)_2\downarrow + 2Na^+ + SO_4^{2-}$.
Сокращённое ионное уравнение: $Cu^{2+} + 2OH^- \rightarrow Cu(OH)_2\downarrow$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 13 расположенного на странице 45 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №13 (с. 45), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















