Номер 2, страница 54 - гдз по химии 9 класс проверочные и контрольные работы Габриелян, Лысова

Авторы: Габриелян О. С., Лысова Г. Г.
Тип: Проверочные и контрольные работы
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-103485-1
Популярные ГДЗ в 9 классе
Тема I. Химические реакции в водных растворах. Химические свойства солей как электролитов. Вариант 1 - номер 2, страница 54.
№2 (с. 54)
Условие. №2 (с. 54)
скриншот условия

2. Верны ли следующие суждения о свойствах солей?
А. Растворимые соли — сильные электролиты.
Б. Соли взаимодействуют со щелочами и кислотами, если в результате образуется осадок или газ.
1) верно только А
2) верно только Б
3) оба суждения верны
4) оба суждения неверны
Решение. №2 (с. 54)
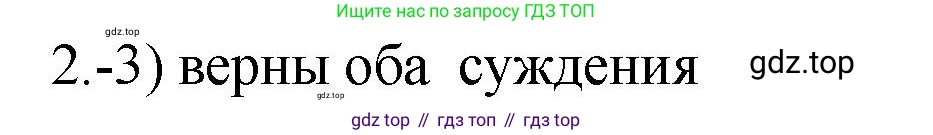
Решение 2. №2 (с. 54)
Для выбора правильного варианта ответа необходимо проанализировать истинность каждого из предложенных суждений.
А. Растворимые соли — сильные электролиты.
Данное утверждение рассматривает свойство солей быть электролитами. Сильные электролиты – это вещества, которые при растворении в воде практически нацело диссоциируют (распадаются) на ионы. Подавляющее большинство солей, растворимых в воде, действительно являются сильными электролитами. Это связано с их ионной природой: в водном растворе ионы, составляющие кристаллическую решетку соли, переходят в раствор. Например, поваренная соль ($NaCl$) или нитрат калия ($KNO_3$) полностью диссоциируют:
$NaCl \rightarrow Na^+_{\text{(aq)}} + Cl^-_{\text{(aq)}}$
$KNO_3 \rightarrow K^+_{\text{(aq)}} + NO_3^-_{\text{(aq)}}$
Однако это правило не является абсолютным. Существуют исключения – растворимые соли, которые являются слабыми электролитами. К ним относятся, например, хлорид ртути(II) ($HgCl_2$), цианид ртути(II) ($Hg(CN)_2$) и ацетат свинца(II) ($Pb(CH_3COO)_2$). Эти вещества растворимы, но в растворе существуют преимущественно в виде недиссоциированных молекул. Поскольку утверждение А сформулировано как универсальное правило (для всех растворимых солей), наличие таких исключений делает его неверным.
Б. Соли взаимодействуют со щелочами и кислотами, если в результате образуется осадок или газ.
Это суждение описывает условия протекания реакций ионного обмена, к которым относятся взаимодействия солей с кислотами и щелочами. Реакции ионного обмена протекают до конца, если в результате образуется вещество, которое выводится из сферы реакции. К таким случаям относятся:
- образование осадка (малорастворимого вещества);
- выделение газа;
- образование слабого электролита (например, воды $H_2O$ или слабой кислоты).
Утверждение Б гласит, что реакция происходит, если образуется осадок или газ. Это является достаточным условием для протекания реакции. Например:
- Реакция соли со щелочью с образованием осадка: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$.
- Реакция соли с кислотой с образованием газа: $Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$.
Если в результате потенциального взаимодействия может образоваться осадок или газ, реакция действительно будет протекать. Утверждение не утверждает, что это единственные условия (оно не исключает случай образования слабого электролита). Следовательно, с логической точки зрения, утверждение является верным.
Таким образом, суждение А является неверным, а суждение Б — верным. Следовательно, из предложенных вариантов правильным является тот, который гласит "верно только Б".
Ответ: 2
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 54 к проверочным и контрольным работам 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 54), авторов: Габриелян (Олег Саргисович), Лысова (Галина Георгиевна), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















