Номер 7, страница 93 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Соли аммония. Примените свои знания - номер 7, страница 93.
№7 (с. 93)
Условие. №7 (с. 93)
скриншот условия

7. С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди(II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
Решение. №7 (с. 93)
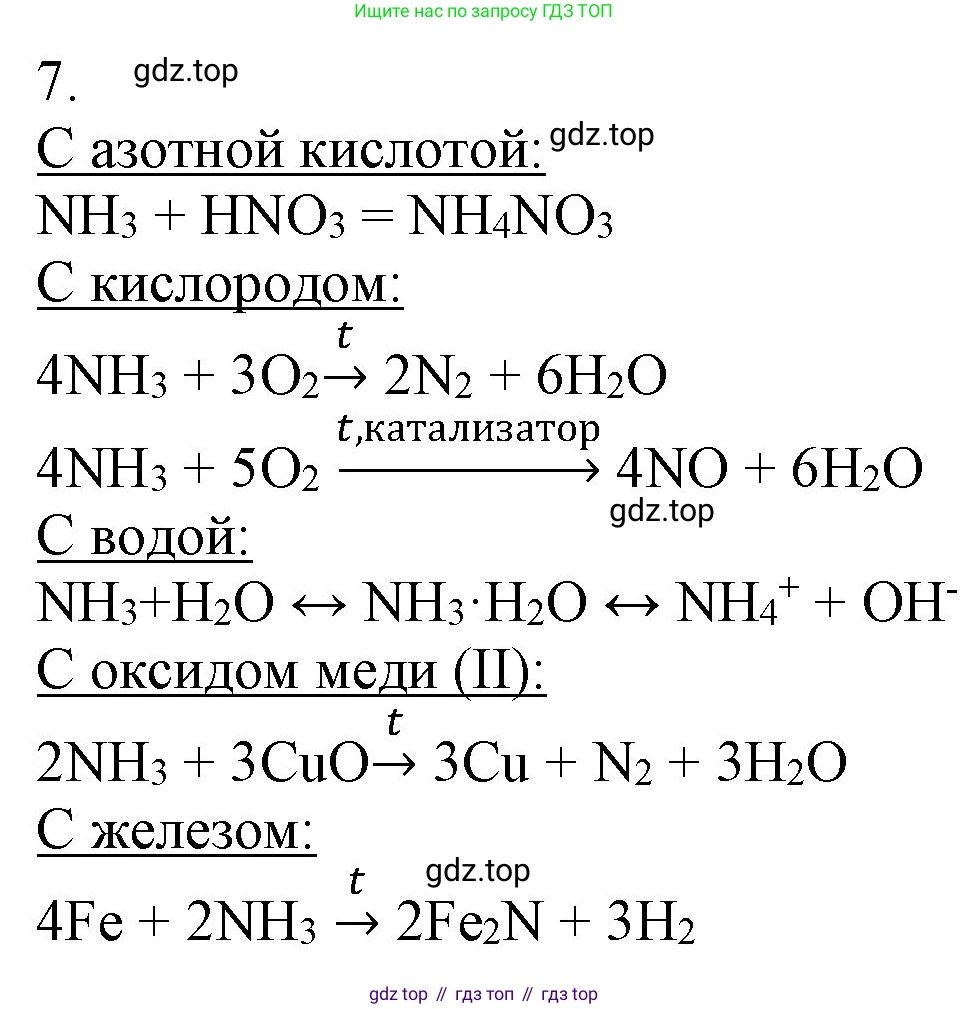
Решение 2. №7 (с. 93)
Аммиак ($NH_3$) — это соединение, которое в химических реакциях может проявлять как основные, так и восстановительные свойства. Его основные свойства обусловлены наличием неподеленной электронной пары у атома азота, а восстановительные — низкой степенью окисления азота (-3). Рассмотрим взаимодействие аммиака с каждым из перечисленных веществ.
Азотная кислота
Аммиак, проявляя свойства основания, реагирует с кислотами. С азотной кислотой ($HNO_3$) происходит реакция нейтрализации, в результате которой образуется соль — нитрат аммония ($NH_4NO_3$).
$NH_3 + HNO_3 \rightarrow NH_4NO_3$
Ответ: $NH_3 + HNO_3 \rightarrow NH_4NO_3$
Кислород
Аммиак горит в кислороде ($O_2$), проявляя восстановительные свойства. В зависимости от условий (наличие катализатора, температура) реакция может идти по-разному.
1. Горение без катализатора приводит к образованию простого вещества азота ($N_2$) и воды.
$4NH_3 + 3O_2 \xrightarrow{t} 2N_2 + 6H_2O$
2. Каталитическое окисление аммиака (например, на платиновом катализаторе) является ключевой стадией в производстве азотной кислоты и приводит к образованию оксида азота(II) ($NO$) и воды.
$4NH_3 + 5O_2 \xrightarrow{кат., t} 4NO + 6H_2O$
Ответ: $4NH_3 + 3O_2 \xrightarrow{t} 2N_2 + 6H_2O$; $4NH_3 + 5O_2 \xrightarrow{кат., t} 4NO + 6H_2O$
Вода
Аммиак хорошо растворяется в воде ($H_2O$), при этом происходит обратимая химическая реакция с образованием гидрата аммиака ($NH_3 \cdot H_2O$), который является слабым основанием и диссоциирует на ионы аммония ($NH_4^+$) и гидроксид-ионы ($OH^-$). Это придает раствору щелочную реакцию.
$NH_3 + H_2O \rightleftharpoons NH_3 \cdot H_2O \rightleftharpoons NH_4^+ + OH^-$
Ответ: $NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$
Оксид меди(II)
При нагревании аммиак выступает как восстановитель по отношению к оксидам многих металлов. В реакции с оксидом меди(II) ($CuO$) он восстанавливает медь до металлического состояния, а сам окисляется до молекулярного азота.
$2NH_3 + 3CuO \xrightarrow{t} 3Cu + N_2 + 3H_2O$
Ответ: $2NH_3 + 3CuO \xrightarrow{t} 3Cu + N_2 + 3H_2O$
Аммиак не реагирует со следующими веществами из списка:
• водород ($H_2$): является продуктом разложения аммиака или реагентом для его синтеза, но не вступает с ним в реакцию в обычных условиях.
• гидроксид натрия ($NaOH$): является основанием, как и аммиак (в водном растворе), поэтому реакция между ними не идет.
• хлорид калия ($KCl$): соль, образованная сильным основанием и сильной кислотой. Реакция ионного обмена с участием слабого основания аммиака невозможна.
• железо ($Fe$): в обычных условиях реакция не идет. Взаимодействие (азотирование) с образованием нитридов железа возможно лишь при очень высоких температурах (500-600°C), что выходит за рамки стандартной программы.
• сульфат аммония ($(NH_4)_2SO_4$): это соль самого аммиака, поэтому они не взаимодействуют.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 7 расположенного на странице 93 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 93), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















