Номер 1, страница 93 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Соли аммония. Проверьте свои знания - номер 1, страница 93.
№1 (с. 93)
Условие. №1 (с. 93)
скриншот условия

1. Составьте схему образования химической связи в молекуле аммиака.
Решение. №1 (с. 93)
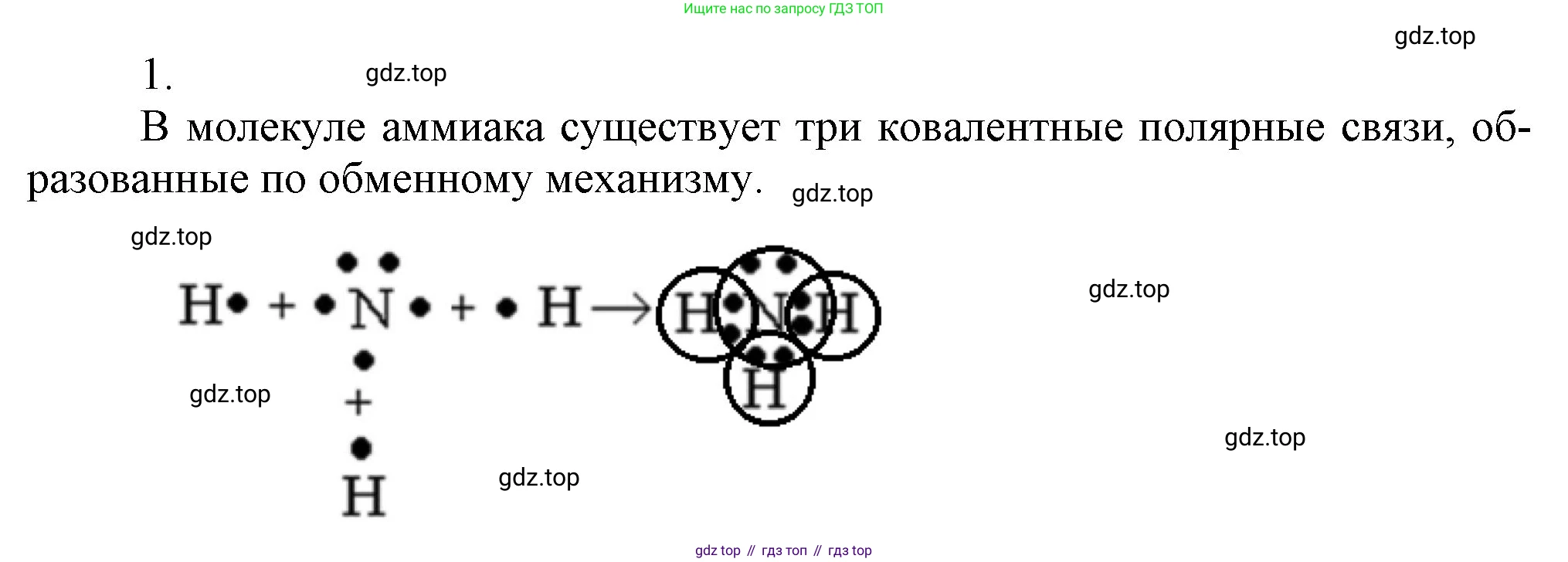
Решение 2. №1 (с. 93)
Решение
Молекула аммиака имеет химическую формулу $NH_3$. Она состоит из одного атома азота (N) и трех атомов водорода (H).
Для составления схемы образования химической связи рассмотрим электронное строение атомов, входящих в состав молекулы.
1. Атом азота (N). Азот находится во 2-м периоде, V группе, главной подгруппе. Порядковый номер – 7. Заряд ядра $+7$. В атоме азота 7 электронов, которые расположены на двух электронных слоях.
- Электронная формула: $_7\text{N}: +7) 2e^-, 5e^-$ или $1s^22s^22p^3$.
- На внешнем электронном слое у атома азота находится 5 валентных электронов. Из них два электрона спаренные (на 2s-подуровне) и три неспаренных (на 2p-подуровне).
- Для завершения внешнего электронного слоя до стабильного октета (8 электронов) атому азота не хватает 3 электронов.
- Электронная схема валентных электронов атома азота (структура Льюиса):
$ \cdot \underset{\cdot}{\overset{\cdot\cdot}{N}} \cdot $
2. Атом водорода (H). Водород находится в 1-м периоде, I группе, главной подгруппе. Порядковый номер – 1. Заряд ядра $+1$. В атоме водорода 1 электрон, расположенный на первом и единственном электронном слое.
- Электронная формула: $_1\text{H}: +1) 1e^-$ или $1s^1$.
- На внешнем электронном слое у атома водорода находится 1 неспаренный валентный электрон.
- Для завершения внешнего электронного слоя до стабильного дублета (2 электрона, как у гелия) атому водорода не хватает 1 электрона.
- Электронная схема атома водорода: $ \text{H} \cdot $
Механизм образования связи:
Связь между неметаллами – азотом и водородом – образуется по ковалентному механизму за счет образования общих электронных пар. Атом азота предоставляет три своих неспаренных электрона для образования трех связей, а каждый из трех атомов водорода предоставляет по одному своему электрону.
Схема образования связей в молекуле аммиака ($NH_3$):
$ \cdot \underset{\cdot}{\overset{\cdot\cdot}{N}} \cdot \quad + \quad 3 \, \text{H} \cdot \quad \longrightarrow \quad \text{H} : \underset{\Large \text{H}}{\overset{\Large \cdot \cdot}{\text{N}}} : \text{H} $
В результате образуются три общие электронные пары между атомом азота и тремя атомами водорода. Каждая общая пара (обозначена двоеточием) образует одну ковалентную связь. На атоме азота остается одна неподеленная (свободная) электронная пара (обозначена двумя точками над символом N).
Таким образом, в молекуле аммиака образуются три одинарные ковалентные полярные связи (N-H). Полярность связи обусловлена разницей в электроотрицательности азота ($ЭО \approx 3.04$) и водорода ($ЭО \approx 2.20$). Общие электронные пары смещены к более электроотрицательному атому азота, на нем возникает частичный отрицательный заряд ($\delta^-$), а на атомах водорода – частичные положительные заряды ($\delta^+$).
Структурная формула молекулы аммиака, где черточкой обозначается ковалентная связь (пара электронов):
$ \text{H} - \underset{\Large \text{H}}{\overset{\Large |}{\text{N}}} - \text{H} $
Часто также изображают неподеленную электронную пару:
$ \text{H} - \underset{\Large \text{H}}{\overset{\Large \cdot \cdot}{\text{N}}} - \text{H} $
В итоге атом азота имеет завершенный внешний электронный слой — октет (8 электронов: 2 своих неподеленных + $3 \times 2$ общих), а каждый атом водорода — завершенный дублет (2 общих электрона).
Ответ:
Химическая связь в молекуле аммиака ($NH_3$) — ковалентная полярная. Она образуется за счет обобществления трех неспаренных валентных электронов атома азота и по одному валентному электрону от трех атомов водорода. В результате образуются три общие электронные пары (три связи N-H), и у атома азота остается одна неподеленная электронная пара. Схема образования:
$ \cdot \underset{\cdot}{\overset{\cdot\cdot}{N}} \cdot \quad + \quad 3 \, \text{H} \cdot \quad \longrightarrow \quad \text{H} : \underset{\Large \text{H}}{\overset{\Large \cdot \cdot}{\text{N}}} : \text{H} $
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 93 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 93), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















